§ 38. Складаныя эфіры
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 38. Складаныя эфіры |
| Напечатано:: | Гость |
| Дата: | Четверг, 3 Июль 2025, 14:28 |
Наменклатура
Вывучаючы карбонавыя кіслоты, мы пазнаёміліся з рэакцыяй этэрыфікацыі — утварэннем складанага эфіру пры ўзаемадзеянні карбонавай кіслаты са спіртам:
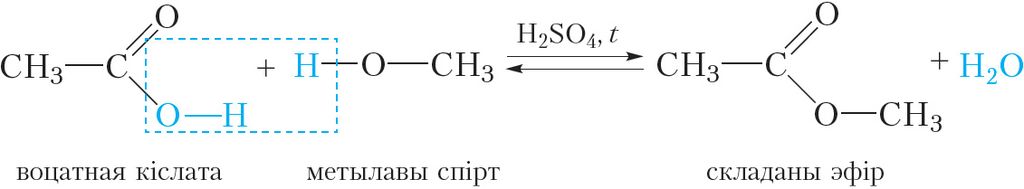
Назву складанага эфіру складаюць з назваў спірту і кіслаты, з якіх ён утвараецца. Напрыклад, прыведзены вышэй складаны эфір утварыўся з метылавага спірту і воцатнай кіслаты, таму яго назва — метылавы эфір воцатнай кіслаты. Існуе іншы спосаб пабудовы назваў складаных эфіраў. У гэтым выпадку зыходзяць з назвы адпаведнага кіслотнага астатку (табл. 33.1) і звязанага з ім радыкала. У прыведзеным вышэй складаным эфіры астатак воцатнай кіслаты (ацэтат) звязаны з метыльным радыкалам. Такі складаны эфір называецца метылацэтат.
Разгледзім другі прыклад. Дадзім назвы складанаму эфіру:
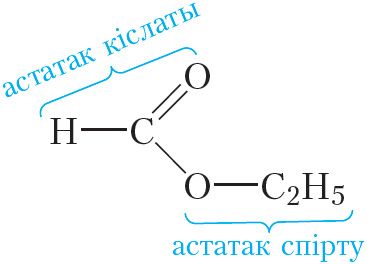
Як бачна, дадзены эфір утвораны астаткамі этылавага спірту і мурашынай кіслаты. Назва дадзенага эфіру — этылавы эфір мурашынай кіслаты, або этылфарміат.
Фізічныя ўласцівасці
Складаныя эфіры найпрасцейшых карбонавых кіслот і спіртоў уяўляюць сабой вадкасці, часта маюць прыемны пах садавіны ці кветак. Напрыклад, пентылавы эфір воцатнай кіслаты мае пах груш, пентылавы эфір бутанавай кіслаты — пах абрыкосаў, бутылавы эфір бутанавай кіслаты — ананасаў і г. д. Сапраўды, прыемныя пахі кветак і садавіны часта абумоўлены наяўнасцю ў іх саставе складаных эфіраў.
Атрыманне
Складаныя эфіры атрымліваюць па ўжо вядомай вам рэакцыі этэрыфікацыі. Напрыклад, этылавы эфір воцатнай кіслаты можна атрымаць з этанолу і воцатнай кіслаты:
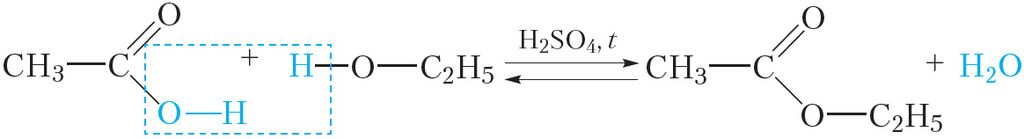
Серная кіслата выступае ў ролі каталізатара. Для правядзення дадзенай рэакцыі выкарыстоўваюць канцэнтраваныя (якія практычна не змяшчаюць ваду) растворы этылавага спірту, воцатнай і сернай кіслаты. У выніку награвання сумесі зыходных рэчываў складаны эфір выдаляецца з рэакцыйнай сумесі ў выглядзе газу і потым кандэнсуецца ў прабірцы-прыёмніку:

Выдаленне этылавага эфіру воцатнай кіслаты з рэакцыйнай сумесі тлумачыцца тым, што сярод усіх рэчываў, якія ўдзельнічаюць у рэакцыі, этылавы эфір воцатнай кіслаты мае найменшую тэмпературу кіпення tкіп = 77 °С. Параўнальна невысокая тэмпература кіпення складанага эфіру абумоўлена тым, што ў яго малекуле адсутнічаюць палярныя групы ![]() OH, такім чынам, паміж малекуламі эфіру не могуць утварацца вадародныя сувязі. У малекулах вады, этанолу, воцатнай і сернай кіслот змяшчаюцца групы
OH, такім чынам, паміж малекуламі эфіру не могуць утварацца вадародныя сувязі. У малекулах вады, этанолу, воцатнай і сернай кіслот змяшчаюцца групы ![]() OH, таму ў гэтых рэчывах маюцца вадародныя сувязі і іх тэмпературы кіпення вышэйшыя, чым у этылавага эфіру воцатнай кіслаты.
OH, таму ў гэтых рэчывах маюцца вадародныя сувязі і іх тэмпературы кіпення вышэйшыя, чым у этылавага эфіру воцатнай кіслаты.
Хімічныя ўласцівасці
Кіслотны гідроліз
Важная хімічная ўласцівасць складаных эфіраў — узаемадзеянне іх з вадой у прысутнасці сернай кіслаты, якая прыводзіць да ўтварэння карбонавай кіслаты і спірту. Гэта рэакцыя называецца кіслотным гідролізам складанага эфіру:
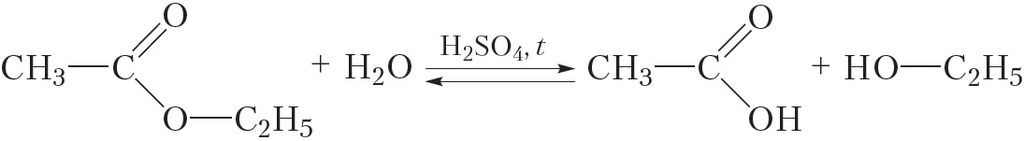
Як бачна, гідроліз складанага эфіру з’яўляецца рэакцыяй, адваротнай рэакцыі этэрыфікацыі. Калі для правядзення рэакцыі этэрыфікацыі выкарыстоўваліся канцэнтраваныя (якія практычна не змяшчаюць ваду) растворы зыходных рэчываў, то гідроліз, наадварот, праводзяць у лішку вады.
Шчолачны гідроліз
Для таго каб прадухіліць адваротную рэакцыю — узаемадзеянне спірту і кіслаты, якія атрымліваюцца, з утварэннем эфіру — можна праводзіць гідроліз у прысутнасці шчолачы (шчолачны гідроліз). У такім выпадку шчолач будзе ператвараць карбонавую кіслату ў соль і тым самым ліквідаваць магчымасць працякання адваротнай рэакцыі:
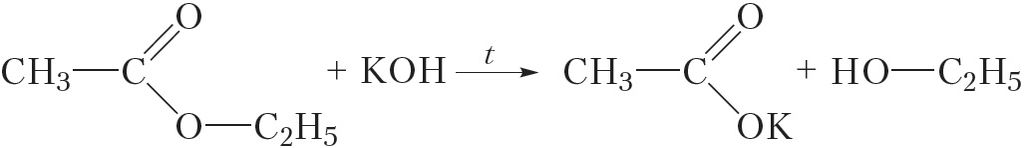
Прымяненне
Дзякуючы прыемнаму паху, складаныя эфіры прымяняюцца ў вытворчасці фруктовых вод, кандытарскіх вырабаў, касметыкі. Некаторыя складаныя эфіры, напрыклад этылавы эфір воцатнай кіслаты, прымяняюць у якасці растваральнікаў.
Сінтэтычнае валакно лаўсан з’яўляецца складаным эфірам палімернай будовы. Яго атрымліваюць у выніку ўзаемадзеяння тэрэфталевай кіслаты і этыленгліколю:
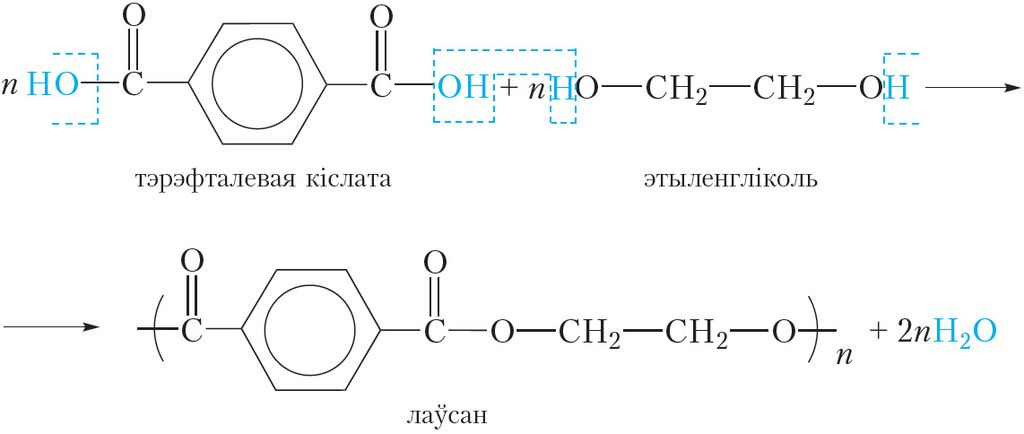
Як бачна, рэчывы ўзаемадзейнічаюць паміж сабой па тыпу рэакцыі этэрыфікацыі, якая мнагакратна паўтараецца, у выніку ўтвараюцца макрамалекулы лаўсану і нізкамалекулярны прадукт — вада. Напомнім, што працэсы, у выніку якіх з нізкамалекулярных рэчываў утвараецца высокамалекулярнае злучэнне і пабочны нізкамалекулярны прадукт, называюцца полікандэнсацыяй (§ 30). Так як лаўсан з’яўляецца прадуктам рэакцыі этэрыфікацыі, якая мнагакратна паўтараецца, яго можна назваць поліэфірам, таму лаўсан адносіцца да сінтэтычных поліэфірных валокнаў. У нашай краіне лаўсан атрымліваюць на ААТ «Магілёўхімвалакно».
Складаныя эфіры ўтвараюцца пры ўзаемадзеянні карбонавых кіслот са спіртамі — рэакцыя этэрыфікацыі. Назвы складаных эфіраў складаюць з назваў спірту і кіслаты, з якіх яны ўтвараюцца.
Складаныя эфіры найпрасцейшых карбонавых кіслот і спіртоў — вадкасці з прыемнымі пахамі.
Складаныя эфіры ўзаемадзейнічаюць з вадой з утварэннем адпаведнай карбонавай кіслаты і спірту.
Сінтэтычнае поліэфірнае валакно лаўсан атрымліваюць у выніку рэакцыі полікандэнсацыі паміж тэрэфталевай кіслатой і этыленгліколем.
Пытанні і заданні
1. Укажыце шарастрыжнёвую мадэль метылавага эфіру мурашынай кіслаты:
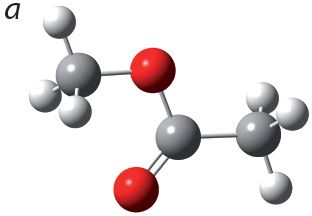
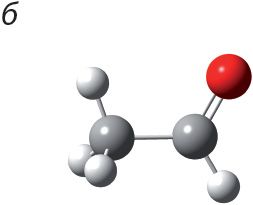
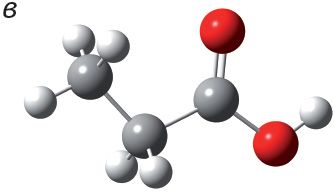
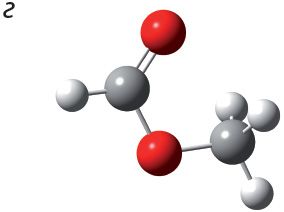
2. Напішыце ўраўненне рэакцыі этэрыфікацыі паміж мурашынай кіслатой і этылавым спіртам. Назавіце складаны эфір, які ўтвараецца.
3. Напішыце структурныя формулы метылавага эфіру мурашынай кіслаты, этылавага эфіру мурашынай кіслаты і метылавага эфіру воцатнай кіслаты. Якія з гэтых рэчываў з’яўляюцца ізамерамі?
4. Вылічыце масу этылавага эфіру воцатнай кіслаты, які можа быць атрыманы пры ўзаемадзеянні 30 г воцатнай кіслаты з 40 г этылавага спірту, калі выхад прадукту рэакцыі складае 75 %.
5*. Структурную формулу макрамалекулы палімера, атрыманага ў выніку рэакцыі полікандэнсацыі, можна прадставіць наступным чынам:
![]()
дзе М — структурнае звяно палімера, n — лік астаткаў манамера ў макрамалекуле, Н ![]() і
і ![]() ОН канцавыя групы макрамалекулы.
ОН канцавыя групы макрамалекулы.
У выніку ўзаемадзеяння этыленгліколю з тэрэфталевай кіслатой утварыўся палімер, у якім лік астаткаў абодвух манамераў аднолькавы. Вызначце сярэдні лік астаткаў этыленгліколю ў макрамалекуле, калі вядома, што маса этыленгліколю, які ўступіў у рэакцыю, роўная 1,86 г, а маса вады, што ўтварылася, — 1,0567 г.
6*. Як з этылену атрымаць этылацэтат? Напішыце ўраўненні рэакцый.
7*. Як з карбіду кальцыю і неарганічных рэчываў атрымаць этылавы эфір воцатнай кіслаты? Напішыце ўраўненні рэакцый.
8*. У выніку спальвання 740 мг арганічнага рэчыва ў лішку кіслароду ўтварылася 540 мг вады і 672 см3 вуглякіслага газу (н. у.). Вядома, што дадзенае арганічнае рэчыва ўяўляе сабой бясколерную вадкасць з прыемным пахам, у прысутнасці шчолачы яно падвяргаецца гідролізу, у выніку якога ўтвараюцца два арганічныя рэчывы.
а) Устанавіце структурную формулу дадзенага арганічнага рэчыва. Напішыце ўраўненне рэакцыі яго гідролізу ў прысутнасці шчолачы.
Дадзенае арганічнае рэчыва мае ізамер, які ўяўляе сабой бясколерную вадкасць з рэзкім пахам, што афарбоўвае раствор лакмусу ў ружовы колер.
б) Напішыце структурную формулу, назву гэтага ізамеру і ўраўненне рэакцыі яго ўзаемадзеяння з пітной содай.
(Адказ:
а) Найпрасцейшая формула С3Н6О2.
Дадзенай найпрасцейшай формуле адпавядае этылфарміат НСООС2Н5.
б) Яго ізамерам, які валодае кіслотнымі ўласцівасцямі, з’яўляецца воцатная кіслата.)