§ 36. Элементы VА-группы. Азот и фосфор
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 36. Элементы VА-группы. Азот и фосфор |
| Напечатано:: | Гость |
| Дата: | Wednesday, 3 September 2025, 22:47 |
Азот и фосфор как химические элементы

Элементы VА-группы азот 7N и фосфор 15Р образуют простые вещества, относящиеся к неметаллам. К этой же группе периодической системы относят мышьяк 33As, сурьму 51Sb и висмут 83Bi. На внешнем электронном слое, общая конфигурация которого ns2np3, их атомы имеют по 5 электронов, из которых три неспаренных на р-подуровне:
Низшая степень их окисления равна ‒3, высшая +5, при этом фосфор чаще всего проявляет положительные степени окисления +3 и +5, а азот образует достаточно устойчивые соединения со степенями окисления +1, +2, +3, +4 и +5. Азот — третий по электроотрицательности элемент после кислорода и фтора, а фосфор незначительно уступает водороду (см. § 11, табл. 7, с. 60).
Распространённость азота и фосфора в природе
Среди элементов VА-группы на Земле наиболее распространён фосфор, его массовая доля — 0,1 %. Азота гораздо меньше, но он преобладает в атмосфере — объёмная доля 78 %, массовая — 75,5 %. Из немногочисленных минералов азота наиболее значимы селитры: NaNO3 — натриевая селитра и KNO3 — калийная селитра.
Фосфор на Земле встречается исключительно в виде соединений и входит в состав фосфоритов и апатитов (их основной компонент — фосфат кальция Ca3(PO4)2), а также фторапатитов Са5[РО4]3F.
Соединения азота и фосфора важны для живых организмов: азот как составная часть аминокислот и белков, фосфор — нуклеиновых кислот, АТФ (аденозинтрифосфорной кислоты), ферментов, костной системы. Для человека суточная потребность в фосфоре достаточно высока — от 1 г до 3,8 г в зависимости от возраста и физиологического состояния организма. При нагрузках потребность возрастает в 1,5–2 раза. Наиболее богаты фосфором ядра семян тыквы, подсолнечника, а также какао, печень, рыба, твёрдые сыры и другие молочные продукты. Недостаток в азоте и фосфоре зачастую испытывают растения. Для возделываемых культур эта проблема решается внесением удобрений.
Азот как простое вещество
Азот как простое вещество состоит из двухатомных молекул N2, графическая формула молекулы азота «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mi mathvariant=¨normal¨»N«/mi»«mo»§#8801;«/mo»«mi mathvariant=¨normal¨»N«/mi»«/math». Атомы азота связаны между собой тремя ковалентными неполярными связями, причём одна из них — σ-связь и две π-связи (рис. 87).
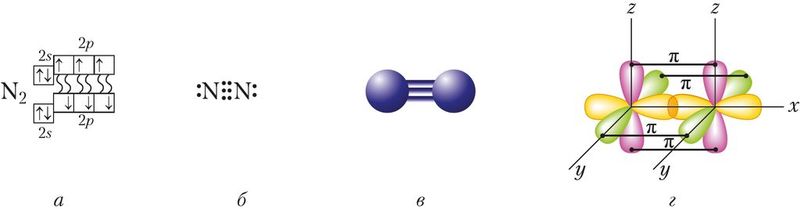
Энергия связи в молекуле азота очень высока и составляет 945 кДж/моль (для сравнения: О2 — 494 кДж/моль, Cl2 — 243 кДж/моль), что свидетельствует о прочности связей, а значит, и большой химической инертности вещества. Действительно, в подавляющем большинстве реакции с участием азота протекают в «жёстких условиях» (при очень высоких температурах и давлениях).
Физические свойства. Небольшое значение относительной молекулярной массы (Мr(N2) = 28) и отсутствие полярности у молекул азота определяют низкие температуры кипения и плавления –196 °С и –210 °С. Азот — газ (н. у.) без цвета и запаха, почти не растворяется в воде.
Химические свойства. Азот в реакциях с кислородом и фтором проявляет свойства восстановителя, а с металлами и водородом — окислителя.
1. Азот как восстановитель. Реакция азота с кислородом протекает при температуре около 3000 °С — в электрической дуге или разряде молнии. Реакция является эндотермической. При этом образуется оксид азота(II):
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mover»«mi mathvariant=¨normal¨»N«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mover»«mrow»«mo»§#160;«/mo»«mo»§#8644;«/mo»«/mrow»«mi»t«/mi»«/mover»«mo»§#160;«/mo»«mover»«mrow»«mn»2«/mn»«mi mathvariant=¨normal¨»N«/mi»«/mrow»«mrow»«mo»+«/mo»«mn»2«/mn»«/mrow»«/mover»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«mo».«/mo»«/math»
2. Азот как окислитель. Реакция азота с водородом протекает при высокой температуре и давлении даже в присутствии катализаторов:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mover»«mi mathvariant=¨normal¨»N«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»3«/mn»«mrow»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mo stretchy=¨false¨»§#8644;«/mo»«mrow»«mi»t«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»p«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»§#1082;§#1072;§#1090;«/mi»«mo».«/mo»«/mrow»«/mover»«munder»«mrow»«mover»«mrow»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»N«/mi»«/mrow»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»3«/mn»«/msub»«/mrow»«mi»§#1072;§#1084;§#1084;§#1080;§#1072;§#1082;«/mi»«/munder»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«mo».«/mo»«/math»
Реагируя с металлами (при повышенной температуре), азот образует бинарные соединения нитриды:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»3«/mn»«mi»Mg«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mrow»«msub»«mover»«mrow»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»N«/mi»«/mrow»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mo»=«/mo»«mi»t«/mi»«/mover»«mo»§#160;«/mo»«msub»«mi»Mg«/mi»«mn»3«/mn»«/msub»«msub»«mover»«mi mathvariant=¨normal¨»N«/mi»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«/math» (нитрид магния).
С литием азот вступает в реакцию без нагревания:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»6«/mn»«mi»Li«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»N«/mi»«mn»0«/mn»«/mover»«mrow»«mn»2«/mn»«mo»§#160;«/mo»«/mrow»«/msub»«mo»=«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mi»Li«/mi»«mn»3«/mn»«/msub»«mover»«mi mathvariant=¨normal¨»N«/mi»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/mover»«/math» (нитрид лития).
Нитриды легко разлагаются водой, образуя аммиак и гидроксиды металлов:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi»Mg«/mi»«mn»3«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»N«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»6«/mn»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«mn»3«/mn»«mi»Mg«/mi»«msub»«mrow»«mo»(«/mo»«mi»§#1054;§#1053;«/mi»«mo»)«/mo»«/mrow»«mn»2«/mn»«/msub»«mo stretchy=¨false¨»§#8595;«/mo»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mi»NH«/mi»«mn»3«/mn»«/msub»«mo stretchy=¨false¨»§#8593;«/mo»«mo».«/mo»«/mrow»«/mstyle»«/math»
Азот получают в промышленных масштабах из сжиженного воздуха, в лаборатории в небольших количествах — разложением нитрита аммония:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi»NH«/mi»«mn»4«/mn»«/msub»«msub»«mi»N§#1054;«/mi»«mn»2«/mn»«/msub»«mover»«mrow»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«msub»«mi mathvariant=¨normal¨»N«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»§#1054;«/mi»«mo».«/mo»«/mrow»«/mstyle»«/math»
Применение. Основная область применения азота — производство аммиака. Его используют также для создания инертной среды при хранении пищевых продуктов, произведений искусства и рукописей, в пожаротушении, лазерной резке металлов. Расширяется спектр его применения в медицине и косметологии, например криоконсервация клеток, криотерапия (удаление папиллом и гемангиом).
Фосфор как простое вещество
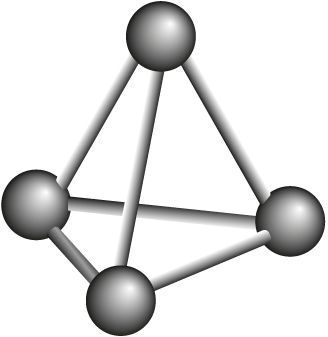
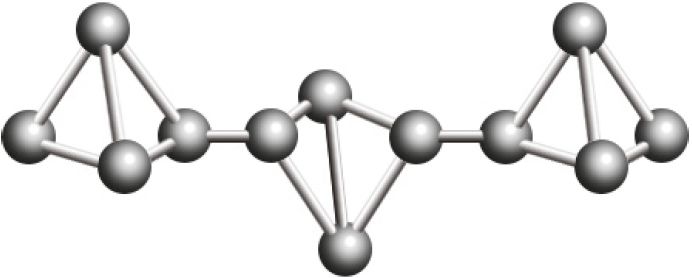
Фосфор, являясь элементом VА-группы, как и азот, способен образовывать молекулу состава P2. Однако, в отличие от молекулы азота, двухатомная молекула фосфора неустойчива. Поэтому фосфор существует в виде нескольких аллотропных модификаций, в которых реализуются лишь одинарные связи Р—Р: фосфор белый, красный, чёрный и другие (табл. 29).
Таблица 29. Строение и физические свойства аллотропных модификаций фосфора
| Аллотропные модификации фосфора | Строение | Температура плавления | Температура кипения |
|
Р4 фосфор белый  |
 |
44 °С | 281 °С |
|
Р фосфор красный  |
 |
260 °С | ‒ Возгоняется при температуре около 400 °С |
|
* Р фосфор чёрный  |
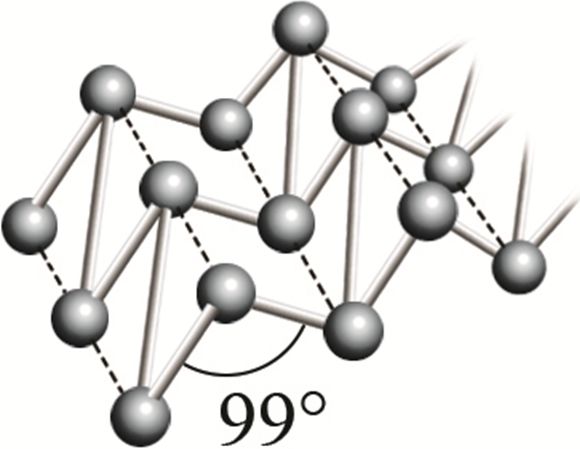
Фрагмент кристаллической решётки чёрного фосфора |
При нагревании (атмосферное давление) превращается в красный фосфор | 1000 °С (при 1,8 ∙ 106 атм) |

Физические свойства. Белый фосфор Р4 представляет собой воскообразное вещество с чесночным запахом, ядовит. На воздухе в темноте светится зеленовато-жёлтым цветом в результате медленной химической реакции окисления (хемилюминесценция (рис. 88)).
Красный фосфор — аморфное вещество полимерного строения, не имеет запаха, его токсичность невысокая.
Между аллотропными модификациями фосфора возможны взаимопревращения, протекающие при определённых температурах и давлениях.
Химические свойства. Как окислитель фосфор при нагревании вступает в реакции с металлами, образуя фосфиды:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»3«/mn»«mi»Mg«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«mi mathvariant=¨normal¨»P«/mi»«mn»0«/mn»«/mover»«mover»«mrow»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«msub»«mi»Mg«/mi»«mn»3«/mn»«/msub»«msub»«mover»«mi mathvariant=¨normal¨»P«/mi»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mo».«/mo»«/math»
С водородом фосфор не реагирует.
Как восстановитель фосфор реагирует с кислородом и другими сильными окислителями. В чистом кислороде и на воздухе фосфор ослепительно горит, образуя белый дым (частицы твёрдых оксидов фосфора):
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»4«/mn»«mover»«mrow»«mi mathvariant=¨normal¨»P«/mi»«mo»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»5«/mn»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»=«/mo»«msub»«mover»«mrow»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»P«/mi»«/mrow»«mrow»«mo»+«/mo»«mn»5«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»5«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«/math» (оксид фосфора(V) в избытке кислорода);
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»4«/mn»«mover»«mrow»«mi mathvariant=¨normal¨»P«/mi»«mo»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»3«/mn»«msub»«mi mathvariant=¨normal¨»O«/mi»«mrow»«mn»2«/mn»«mo»§#160;«/mo»«/mrow»«/msub»«mo»=«/mo»«mo»§#160;«/mo»«msub»«mover»«mrow»«mn»2«/mn»«mi mathvariant=¨normal¨»P«/mi»«/mrow»«mrow»«mo»+«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«/math» (оксид фосфора(III) при недостатке кислорода).
Белый фосфор может самовоспламеняться на воздухе, а красный загорается лишь при поджигании, что объясняется различной прочностью химических связей между атомами фосфора в аллотропных модификациях.
Фосфор получают прокаливанием смеси фосфата кальция с песком и углём:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mn»2«/mn»«msub»«mi»Ca«/mi»«mn»3«/mn»«/msub»«msub»«mrow»«mo»(«/mo»«msub»«mi»PO«/mi»«mn»4«/mn»«/msub»«mo»)«/mo»«/mrow»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»6«/mn»«msub»«mi»SiO«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»10«/mn»«mi mathvariant=¨normal¨»C«/mi»«mo»§#160;«/mo»«mover»«mo»=«/mo»«mrow»«mn»1400«/mn»«mo»§#8211;«/mo»«mn»1600«/mn»«mo»§#160;«/mo»«mo»§#176;«/mo»«mi mathvariant=¨normal¨»§#1057;«/mi»«/mrow»«/mover»«mo»§#160;«/mo»«mn»6«/mn»«msub»«mi»CaSiO«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»10«/mn»«mi»CO«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»P«/mi»«mn»4«/mn»«/msub»«mo».«/mo»«/mrow»«/mstyle»«/math»
Не реагируя с водородом непосредственно, фосфор тем не менее образует водородные соединения. Так, фосфин можно получить косвенно, например, из фосфидов, которые разрушаются как водой, так и кислотами: Mg3Р2 + 6H2O = 3Mg(ОН)2↓ + 2РH3↑.
Фосфин РH3 — газ с чесночным запахом.
В природе водородные соединения фосфора встречаются там, где происходит интенсивное разложение белковых веществ.
Применение. Белый фосфор используют для производства фосфорных кислот и их производных, в металлургии как компонент некоторых жаропрочных сплавов. Красный фосфор применяют в производстве спичек, в органическом синтезе (лекарственные препараты, ядохимикаты). Образцы фосфора, содержащие нуклид 32Р («меченый атом») с периодом полураспада 14,22 суток, используют в исследовательских работах.
Низшая степень окисления азота и фосфора –3, высшая +5.
Инертность простого вещества азот обусловлена наличием тройной связи в молекуле N2.
Фосфор существует в виде нескольких аллотропных модификаций: белый, красный и другие.
Азот и фосфор проявляют как восстановительные, так и окислительные свойства. Фосфор не реагирует с водородом.
Вопросы, задания, задачи
1. Назовите:
- а) формулу простого вещества азот;
- б) формулу белого фосфора;
- в) низшую степень окисления азота;
- г) высшую степень окисления фосфора;
- д) особенности запаха белого фосфора;
- е) аллотропную модификацию фосфора, используемого в производстве спичек;
- ж) природные соединения фосфора;
- з) химические формулы калиевой селитры, натриевой селитры;
- и) содержание азота в воздухе.
2. Запишите символы элементов VA-группы и общую формулу их электронной конфигурации.
3. Охарактеризуйте электронное строение атомов азота и фосфора.
4. Опишите физические свойства азота и аллотропных модификаций фосфора.
5. Заполните таблицу для реагентов кислород, водород, литий, магний (впишите в своей тетради соответствующие уравнения возможных реакций).
| Реагент | N2 | P |
Сделайте выводы о сходстве и различии свойств азота и фосфора.
6. При взаимодействии кальция массой 0,9 г с азотом получено соединение массой 1,11 г. Установите химическую формулу соединения.
7. Фосфор окисляется хлором, азотной и серной кислотами. Расставьте коэффициенты методом электронного баланса в схемах этих реакций:
- а) Р + Сl2 → PCl5;
- б) Р + КСlO3 → P2O5 + KCl;
- в) Р + HNO3(разб) + H2О → H3PO4 + NO;
- г) Р + H2SO4(конц) → H3PO4 + SO2 + H2О.
8. Рассчитайте массу белого фосфора, который можно получить при прокаливании с песком и углём фосфорита, содержащего фосфат кальция массой 6,2 т, если выход продукта составляет 92 %. Реакция протекает согласно уравнению на с. 201.
9. Как влияет повышение температуры и давления на смещение равновесия в реакциях:
- а) «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mi mathvariant=¨normal¨»N«/mi»«mrow»«mrow»«mn»2«/mn»«mo»(«/mo»«/mrow»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«/mrow»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mrow»«mn»2«/mn»«mo»(«/mo»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«/mrow»«/msub»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mi»NO«/mi»«mrow»«mo»(«/mo»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«mo»§#160;«/mo»«/mrow»«/msub»«mo»§#8211;«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«/math»;
- б) «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mi mathvariant=¨normal¨»N«/mi»«mrow»«mn»2«/mn»«mo»(«/mo»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«/mrow»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»3«/mn»«msub»«mi mathvariant=¨normal¨»H«/mi»«mrow»«mn»2«/mn»«mo»(«/mo»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«/mrow»«/msub»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mi»NH«/mi»«mrow»«mn»3«/mn»«mo»(«/mo»«mi mathvariant=¨normal¨»§#1075;«/mi»«mo»)«/mo»«/mrow»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«/math»?
10. В замкнутый сосуд поместили водород химическим количеством 6 моль и азот количеством 4 моль и нагрели до 450 °С в присутствии катализатора. Определите объёмную долю аммиака в конечной смеси, если доля вступившего в реакцию азота равна 15 %.
*Самоконтроль
1. Тройную связь содержит молекула:
- а) Н2;
- б) N2;
- в) Р4;
- г) О2.
2. Фосфор как элемент характеризуют утверждения:
- а) входит в состав костной ткани преимущественно в виде фосфата кальция;
- б) высшая степень окисления равна +5;
- в) красный фосфор является компонентом покрытия на спичечных коробках;
- г) белый фосфор имеет молекулярное строение.
3. Фосфор не реагирует даже при нагревании с:
- а) Мg;
- б) Zn;
- в) О2;
- г) Н2.
4. Азот имеет положительную степень окисления в соединениях:
- а) NO;
- б) NaNO3;
- в) КNO3;
- г) Na3N.
5. Фосфор выступает в роли окислителя, реагируя с:
- а) Na;
- б) Zn;
- в) Са;
- г) Cl2.