§ 14.1. Гібрыдызацыя атамных арбіталей
Самакантроль
1. Валентны вугал вызначаецца:
- а) колькасцю атамных арбіталей дадзенага атама, якія ўдзельнічаюць ва ўтварэнні σ-сувязей з іншымі атамамі;
- б) колькасцю σ-сувязей, якiя ўтвараюцца дадзеным атамам;
- в) колькасцю π-сувязей, якiя ўтвараюцца дадзеным атамам;
- г) тыпам гібрыдызацыі атамных арбіталей.
2. У гібрыдызацыі атамных арбіталей удзельнічаюць:
- а) розныя па энергіі, але блізкія па форме атамныя арбіталі;
- б) розныя па форме, але блізкія па энергіі атамныя арбіталі;
- в) 1s-арбіталь і 2p-арбіталі;
- г) 2s-арбіталь і 2p-арбіталі.
3. Тып гібрыдызацыі, паказаны на схеме, характэрны для атамаў у малекулах:
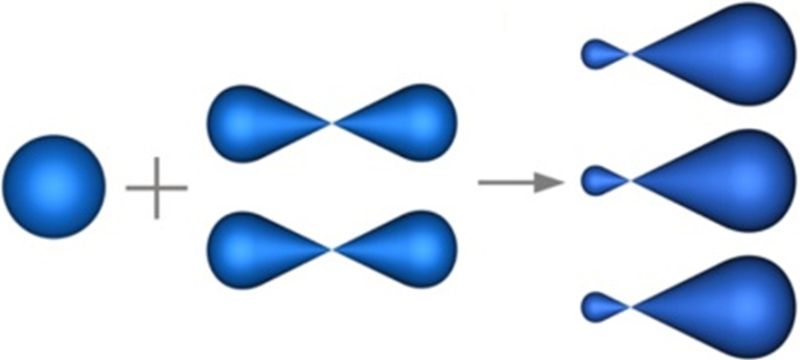
- а) НС≡СН;
- б) Н2С=СН2;
- в) ВF3;
- г) CF4.
4. sp-Гібрыдныя арбіталі:
- а) утвораны дзвюма s-арбіталямі;
- б) утвораны адной s- і адной p-арбіталямі;
- в) арыентаваны адна да адной пад вуглом 180°;
- г) арыентаваны адна да адной пад вуглом 90°.
5. Прасторавая будова малекул:
- а) лінейная ў выпадку sp-гібрыдызацыі;
- б) лінейная ў выпадку sp2-гібрыдызацыі;
- в) тэтраэдрычная ў выпадку sp2-гібрыдызацыі;
- г) тэтраэдрычная ў выпадку sp3-гібрыдызацыі.