§ 14.1. Гібрыдызацыя атамных арбіталей
Пытанні, заданні, задачы
1. Растлумачце прасторавую будову малекулы метану.
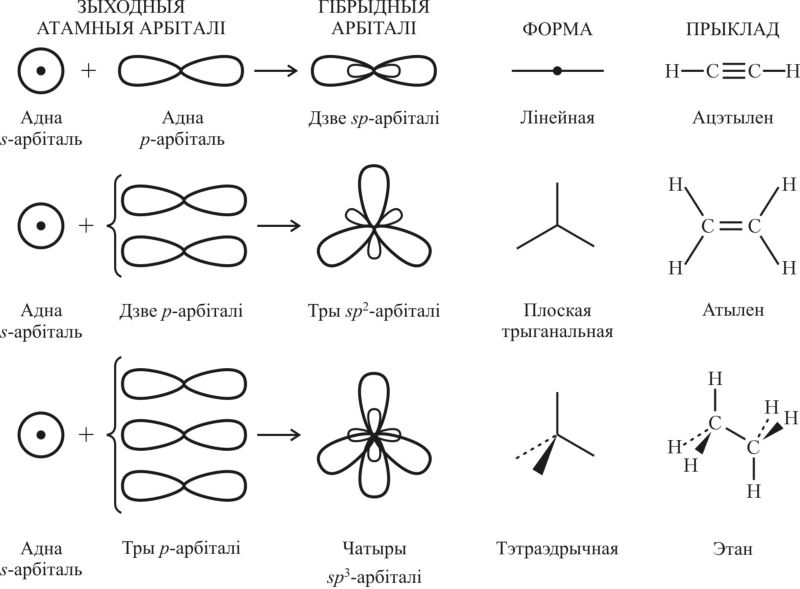
2. Выкарыстоўваючы свой вопыт тлумачэння будовы малекул вуглевадародаў, пракаментуйце схемы, паказаныя на малюнку 32.1.
3. Параўнайце прасторавую будову малекулы аміяку і іона амонію. Растлумачце адрозненне.
4. Згодна з эксперыментальнымі дадзенымі малекула CO2 мае лінейную будову. Растлумачце значэнне валентнасці вугла ў гэтай малекуле, зыходзячы з ўяўлення аб гібрыдызацыі атамных арбіталей.
5. З улікам тыпу гібрыдызацыі атамных арбіталей вызначце лік атамаў вугляроду, атамныя арбіталі якіх знаходзяцца ў стане sp2-гібрыдызацыі, у малекуле алеінавай кіслаты СН3(СН2)7СНСН(СН2)7СООН.
6. Вызначце тып гібрыдызацыі атамных арбіталей цэнтральнага атама і растлумачце прасторавую будову наступных малекул і іонаў: CCl4 (валентны вугал Cl—C—Cl роўны 109,5°), SiH4 (валентны вугал H—Si—H роўны 109,5°), BF3 (валентны вугал F—B—F роўны 120°), (валентны вугал F—B—F роўны 109,5°).
7. Намалюйце прасторавую будову малекул і іонаў, названых у заданні 6.
8. Выкарыстоўваючы ўяўленне аб гібрыдызацыі атамных арбіталей, растлумачце прасторавую будову малекул бутану, транс-бутэну-2, метылбензолу, бензойнай кіслаты, фармальдэгіду і прапіну.
9. Выкарыстоўваючы паняцце гібрыдызацыі, прадкажыце, якую форму павінны мець малекулы: HClO, HClO4, HNO3. Укажыце значэнні валентных вуглоў і супастаўце ваш адказ з дадзенымі ў сетцы інтэрнэт.
10. Размясціце наступныя малекулы ў парадку павелічэння валентных вуглоў: СО2, NH3, Н2О, BCl3, CCl4, CH4, CH3NH2, .