§ 38. Азотная кислота
Нитраты
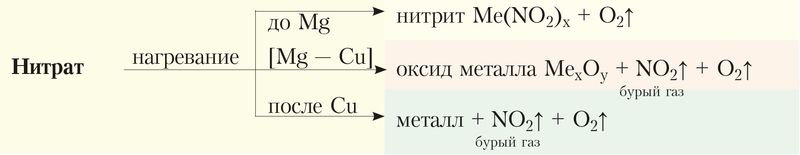
Соли азотной кислоты все без исключения хорошо растворимы в воде. Важнейшим химическим свойством нитратов является их способность разлагаться при нагревании с образованием кислорода. Состав образующихся продуктов зависит от активности металла.
1. Нитраты щелочных и щёлочноземельных металлов образуют нитрит и кислород:
.
2. Нитраты металлов, расположенных в ряду активности от магния до меди, разлагаются с образованием оксида металла, оксида азота(IV) и кислорода:
.
3. Нитраты металлов, расположенных в ряду активности после меди, при разложении образуют металл, оксид азота(IV) и кислород:
.
Термическое разложение нитратов можно представить схемой:
Выделение кислорода при разложении позволяет обнаружить нитрат по «вспышке твёрдой соли на раскалённом угольке» (Приложение 3).
Следует отметить, что нитрат аммония, разлагаясь при температуре не выше 200 °С, кислорода не образует:
.
Применение нитратов. Нитраты натрия, калия, кальция, аммония (NaNO3, КNO3, Са(NO3)2, NH4NO3) называют селитрами и используют в качестве удобрений. Ещё одно важное направление использования нитратов — пиротехника: нитраты разлагаются при нагревании с выделением кислорода, который является сильным окислителем, особенно в момент выделения. Кислород при этом служит окислителем других компонентов пороха.
Разложение нитрата натрия можно использовать в лаборатории для получения кислорода:
(продукты — кислород и нитрит натрия — соль слабой азотистой кислоты).
Нитрат серебра(I) — составную часть ляписа — используют в медицинских целях. В пищевой промышленности используют нитрат и нитрит натрия как консерванты (Е251, Е250) для сыров и колбасных изделий. Мясным изделиям эти соли придают яркий розово-красный цвет. Этими солями пользовались ещё древние греки и египтяне.