§ 31. Соединения галогенов
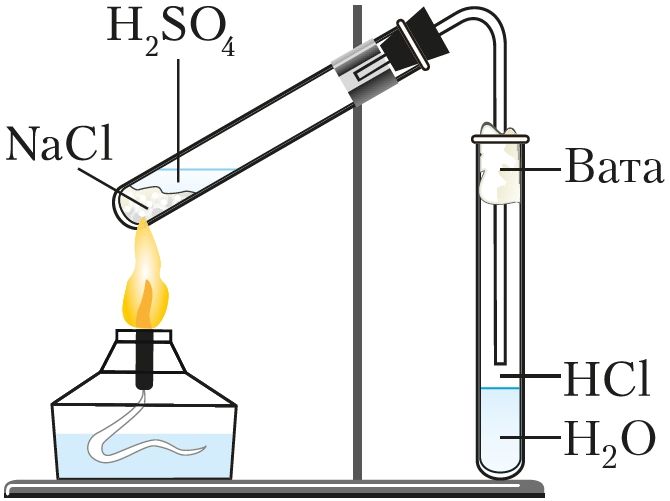
кислоты в лаборатории
Хлороводородная кислота
Хлороводородная (соляная) кислота HCl — крупнотоннажный продукт химической промышленности. Oна является водным раствором хлороводорода, который представляет собой бесцветный газ с резким запахом. Растворимость HCl при 20 °С составляет около 450 объёмов на 1 объём воды.
Концентрированная соляная кислота, содержащая 36–38 % хлороводорода и имеющая плотность 1,19 г/см3, дымит на воздухе, так как из неё выделяется газообразный хлороводород. Разбавленные растворы НСl не дымят.
В промышленности соляную кислоту получают растворением в воде хлороводорода. При этом хлороводород синтезируют из простых веществ:
H2 + Cl2 = 2HCl.
В лабораторных условиях хлороводород получают действием концентрированной серной кислоты на хлориды (NaCl или KCl) при нагревании (рис. 71):
.
Химические свойства. Являясь сильным электролитом, хлороводородная кислота диссоциирует с образованием ионов водорода и хлорид-ионов:
HCl → H+ + Cl–
и обладает всеми общими свойствами кислот: действует на индикаторы и образует соли (хлориды) при взаимодействии с металлами (1), основными и амфотерными оксидами (2), гидроксидами металлов (3), солями (4):
| 1 | Fe + 2HCl = FeCl2 + H2↑ металл |
Fe0 + 2H+ = Fe2+ + H2↑ |
| 2 | МgO + 2HCl = MgCl2 + H2O оксид основный |
MgO + 2H+ = Mg2+ + H2O |
| ZnO + 2HCl = ZnCl2 + H2O оксид амфотерный |
ZnO + 2H+ = Zn2+ + H2O | |
| 3 | КOH + HCl = КCl + H2O основание (щёлочь) |
H+ + OH– = H2O |
| Al(OH)3 + 3HCl = AlCl3 + 3H2O амфотерный гидроксид |
3H+ + Al(OH)3 = Al3+ + 3H2O | |
| 4 | Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ соль |
2H+ + |
К специфическим свойствам соляной кислоты следует отнести реакции, обусловленные наличием аниона Сl–. Выделим два важнейших.
1. Реакции окисления хлорид-ионов. Ион хлора в составе хлороводородной кислоты имеет низшую степень окисления –1 и способен её повышать при потере электронов. Значит, за счёт ионов хлора кислота является восстановителем. Например, для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, КМnO4, КClO3):
.
2. Реакции связывания аниона Сl– c катионами некоторых металлов, например свинца Pb2+, серебра Ag+ в растворе. Это иллюстрируют уравнения реакций:
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3;
Pb2+ + 2Cl– = PbCl2↓;
HCl + AgNO3 = AgCl↓ + HNO3;
Ag+ + Cl– = AgCl↓.
Действие нитрата серебра(I) приводит к образованию белого творожистого осадка AgCl, что используют как тест (качественная реакция) на хлорид-ионы (Приложение 3).