§ 17. Межмолекулярное взаимодействие и водородная связь
Водородная связь
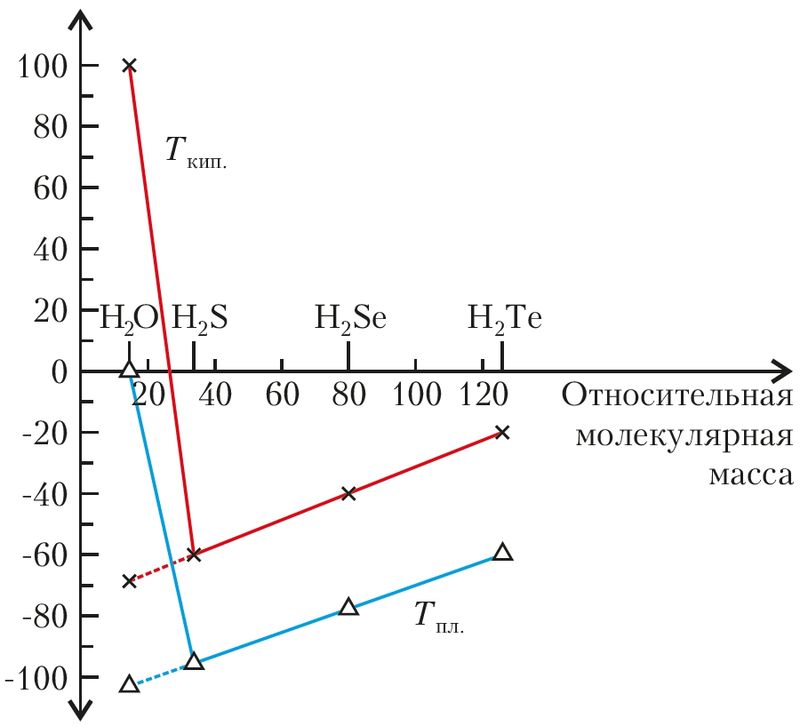
и кипения водородных соединений
элементов VIA-группы от относительной
молекулярной массы молекул Э2S.
Пунктиром обозначена зависимость,
которая могла бы существовать
в отсутствие водородной связи
При изучении органических веществ вы познакомились с закономерностью: чем больше масса и размер молекулы, тем выше температуры плавления и кипения молекулярного вещества. Если следовать этой логике, то между молекулами воды межмолекулярное взаимодействие должно быть слабее, чем между молекулами водородных соединений других элементов VIA-группы. В ряду H2O, H2S, H2Se, H2Te у молекулы воды самая маленькая молекулярная масса — 18 а. е. м. Вода должна была бы плавиться при температуре примерно –100 °С, а кипеть — при –80 °С. На самом деле температуры плавления (0 °С) и кипения (100 °С) воды аномально высокие (рис. 42). Разберёмся, в чём тут причина.
Объяснить это явление можно наличием, помимо обычных межмолекулярных связей между молекулами воды, дополнительного особого типа межмолекулярного взаимодействия, которое получило название водородная связь.
Под водородной понимают связь, образованную в результате электростатического взаимодействия между атомом водорода одной молекулы и более электроотрицательным атомом другой молекулы, несущим отрицательный заряд и имеющим неподелённую электронную пару.
Объясним механизм образования водородной связи с учётом электронного и пространственного строения молекул воды (рис. 43, а).
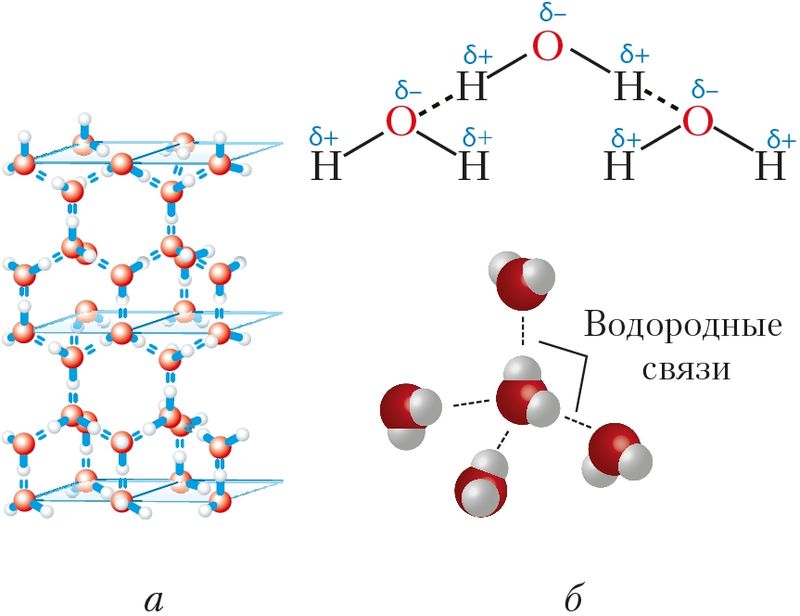
связей между молекулами воды:
а — водородные связи в структуре льда;
б — строение молекулы воды
и обозначение водородной связи
В силу полярности молекулы воды положительно заряженный атом водорода одной молекулы притягивается под действием электростатических сил к отрицательно заряженному атому кислорода другой молекулы (рис. 43, б). В этом взаимодействии присутствует и частичное ковалентное связывание между кислородом и водородом соседних молекул по механизму донорно-акцепторного взаимодействия. Оно возможно благодаря тому, что атом кислорода в молекуле воды в значительной степени оттягивает на себя общую электронную пару от водорода, как бы «опустошая» его атомную орбиталь. На этой «пустой» орбитали частично размещается неподелённая электронная пара атома кислорода соседней молекулы.
Водородная связь присутствует у всех веществ, содержащих атомы водорода, химически связанные с более электроотрицательным атомом. Но её проявление хорошо заметно при значительном различии электроотрицательностей водорода и связанного с ним ковалентной связью атома. Самые сильные водородные связи возникают в присутствии самых электроотрицательных элементов — фтора, кислорода и азота (рис. 44).
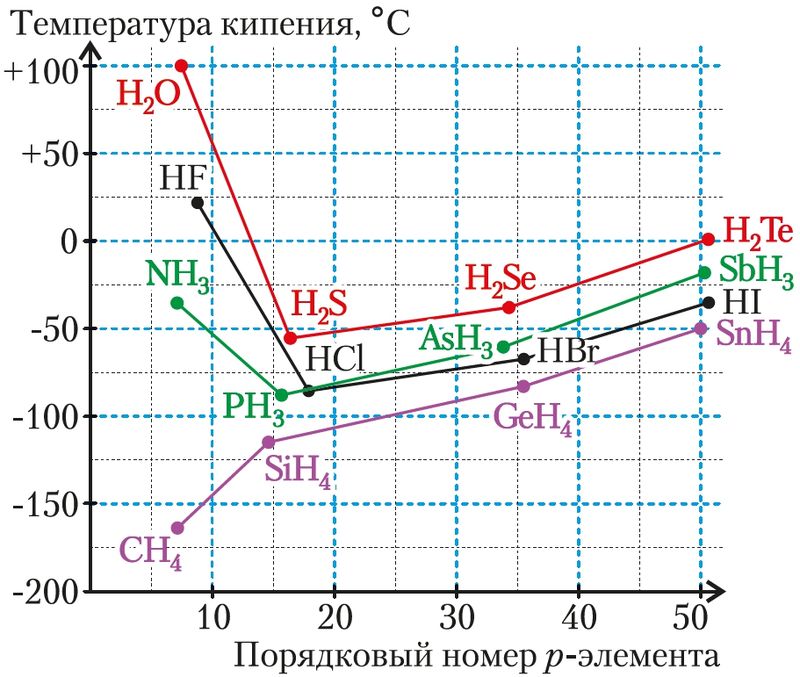
на температуру кипения водородных
соединений р-элементов IVA–VIIA-групп
Водородная связь имеет энергию порядка 20–160 кДж/моль, что значительно ниже энергии химической связи (порядка 400–900 кДж/моль) и выше энергии межмолекулярного взаимодействия (2–10 кДж/моль).
Уникальность воды состоит в том, что молекулы Н2О способны образовывать разветвлённую сеть водородных связей — четыре на одну молекулу (рис. 43, б). Благодаря водородным связям вода обладает способностью существовать в условиях Земли сразу в трёх агрегатных состояниях — твёрдом, жидком и газообразном. При этом температурный диапазон от 0 до 100 °С благоприятен для существования всего живого на планете. Благодаря четырём водородным связям молекулы воды в твёрдом состоянии образуют ажурную кристаллическую структуру льда, похожую на структуру алмаза (рис. 43, а). Полости в этой структуре делают лёд менее плотным, чем жидкая вода, поэтому лёд не тонет и, покрывая водоёмы, не даёт им промёрзнуть до дна.
Прочные водородные связи образуются не только в воде, но и между молекулами неорганических и карбоновых кислот, фенолов, спиртов, аммиака, аминов.
Вещества, способные образовывать межмолекулярные водородные связи, обычно заметно растворимы в воде, имеют относительно высокие температуры плавления и кипения, а также значительную вязкость, например глицерин и фосфорная кислота.
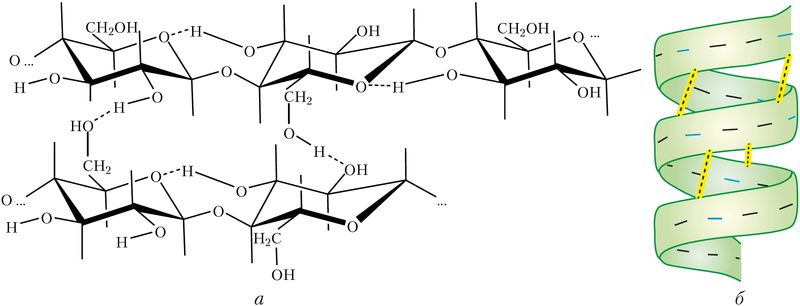
Водородные связи могут быть не только межмолекулярными, но и внутримолекулярными. Так, макромолекулы целлюлозы представляют собой длинные цепи с внутримолекулярными водородными связями, уложенные параллельно и соединённые между собой множеством межмолекулярных водородных связей. Это придаёт целлюлозе механическую прочность при сохранении эластичности (рис. 45, а). Водородные связи определяют формирование вторичной структуры макромолекул белка (рис. 45, б).