§ 14.1. Гибридизация атомных орбиталей
Вопросы, задания, задачи
1. Объясните пространственное строение молекулы метана.
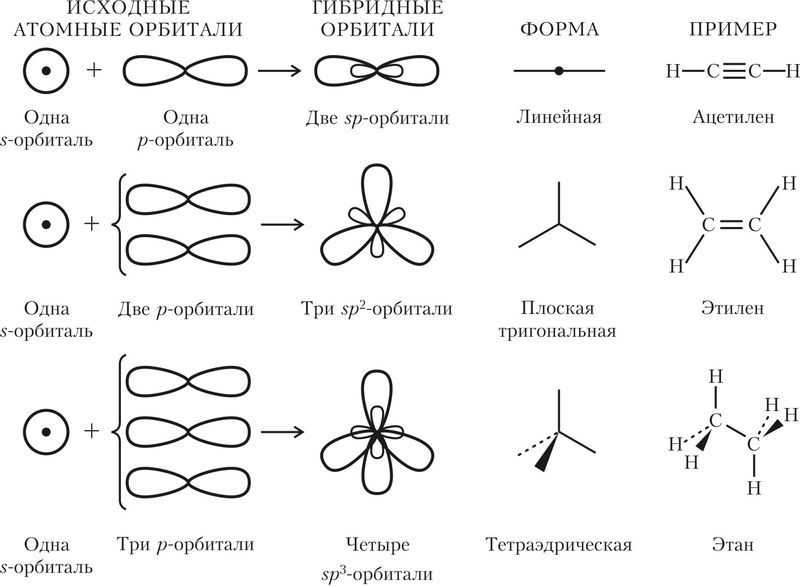
2. Используя свой опыт объяснения строения молекул углеводородов, прокомментируйте схемы, представленные на рисунке 32.1.
3. Сравните пространственное строение молекулы аммиака и иона аммония. Объясните различие.
4. Согласно экспериментальным данным молекула CO2 имеет линейное строение. Объясните значение валентного угла в этой молекуле, исходя из представления о гибридизации атомных орбиталей.
5. С учётом типа гибридизации атомных орбиталей определите число атомов углерода, атомные орбитали которых находятся в состоянии sp2-гибридизации, в молекуле олеиновой кислоты СН3(СН2)7СНСН(СН2)7СООН.
6. Определите тип гибридизации атомных орбиталей центрального атома и объясните пространственное строение следующих молекул и ионов: CCl4 (валентный угол Cl—C—Cl равен 109,5°), SiH4 (валентный угол H—Si—H равен 109,5°), BF3 (валентный угол F—B—F равен 120°), (валентный угол F—B—F равен 109,5°).
7. Изобразите пространственное строение молекул и ионов, указанных в задании 6.
8. Используя представление о гибридизации атомных орбиталей, объясните пространственное строение молекул бутана, транс-бутена-2, метилбензола, бензойной кислоты, формальдегида и пропина.
9. Используя понятие гибридизации, предскажите, какую форму должны иметь молекулы: HClO, HClO4, HNO3. Укажите значения валентных углов и сопоставьте ваш ответ с данными в сети Интернет.
10. Расположите следующие молекулы в порядке увеличения валентных углов: СО2, NH3, Н2О, BCl3, CCl4, CH4, CH3NH2, .