§ 5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ
Закон сохранения массы веществ
Закон сохранения массы веществ позволяет вычислять массы веществ, вступающих в реакцию или образующихся в результате её протекания.
Напомним, что процесс превращения одних веществ в другие без изменения общего числа и природы атомов, из которых эти вещества состоят, называют химической реакцией. Вступающие в химическую реакцию вещества — это реагенты, а образующиеся в результате химической реакции вещества — это продукты.
Протекание химических реакций подчиняется закону сохранения массы веществ: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
Действие закона можно показать на следующем примере. Если закрытую колбу с небольшим количеством фосфора взвесить, а затем нагреть, то фосфор загорается ярким пламенем, а колба наполняется белым дымом. Повторное взвешивание показывает, что общая масса колбы с содержимым не изменилась (рис. 10).
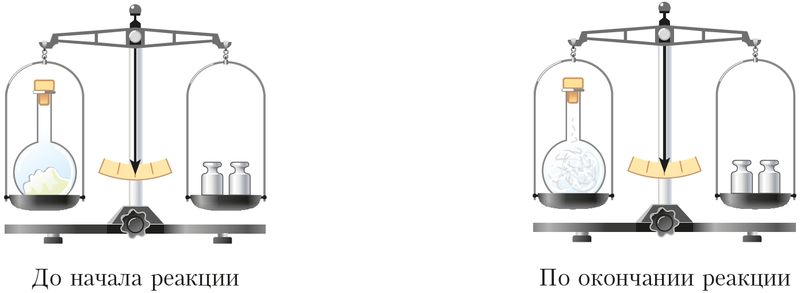
С позиции атомно-молекулярного учения закон можно объяснить тем, что при химических реакциях атомы не исчезают и не возникают вновь, их общее число остаётся неизменным, а значит, и суммарные массы веществ до и после реакции одинаковы.
Большой вклад в экспериментальное доказательство закона сохранения массы веществ внесли опыты русского учёного М. В. Ломоносова и французского химика А. Лавуазье (2-я половина XVIII в.) по измерению массы исходных веществ и массы получаемых из них продуктов.
Покажем, как можно использовать закон сохранения массы веществ для количественных расчётов по уравнениям реакций на примере горения метана в кислороде с образованием воды и углекислого газа.
Схема этой реакции:
Перед формулами поставим коэффициенты, которые должны уравнять число атомов реагентов и продуктов:
Это уравнение свидетельствует о том, что образование одной молекулы углекислого газа и двух молекул воды происходит, если одна молекула метана прореагирует с двумя молекулами кислорода. Коэффициенты показывают, в каком мольном соотношении реагируют вещества и образуются продукты. Так, из составленного уравнения реакции видно, что если в реакцию вступает 1 моль метана, то на его сжигание расходуется 2 моль кислорода, в результате образуются 2 моль воды и 1 моль углекислого газа.
С учётом этих количественных соотношений можно рассчитать массу (количество, объём) реагентов, необходимых для получения определённого количества продуктов, и наоборот — продуктов по исходным веществам.
Пример 2. Определите массу сульфата алюминия, образовавшегося при полном растворении алюминия массой 13,5 г в разбавленной серной кислоте.
Дано:
m(Аl) = 13,5 г
m(Al2(SО4)3) — ?
Решение
M(Al) = 27 г/моль; M(Al2(SO4)3) = 342 г/моль.
Количество алюминия, вступившего в химическую реакцию:
С учётом в уравнении реакции коэффициентов имеем:
откуда
, то есть n(Al2(SO4)3) = 0,25 моль.
Масса соли:
m(Al2(SO4)3) = n(Al2(SO4)3) ∙ M(Al2(SO4)3) = 0,25 моль ∙ 342 г/моль = 85,5 г.
Ответ: m(Al2(SO4)3) = 85,5 г.
Пример 3. При горении магния массой 1,2 г образовался его оксид массой 2 г. Определите объём кислорода (н. у.), израсходованного на горение магния.
Решить такую задачу можно как с помощью уравнения реакции, так и без него. Рассмотрим второй способ.
Дано:
m(Mg) = 1,2 г
m(MgO) = 2 г
V(O2) — ?
Решение
Согласно закону сохранения массы веществ, масса образовавшихся веществ равна массе веществ, вступивших в химическую реакцию:
Поэтому масса кислорода равна:
а его количество составляет:
Объём кислорода равен:
Ответ: V(O2) = 0,56 дм3.