§ 24-1. Трансляция. Созревание белков
Трансляция. Процесс синтеза белка из аминокислот, который осуществляется в рибосомах, называется трансляцией.
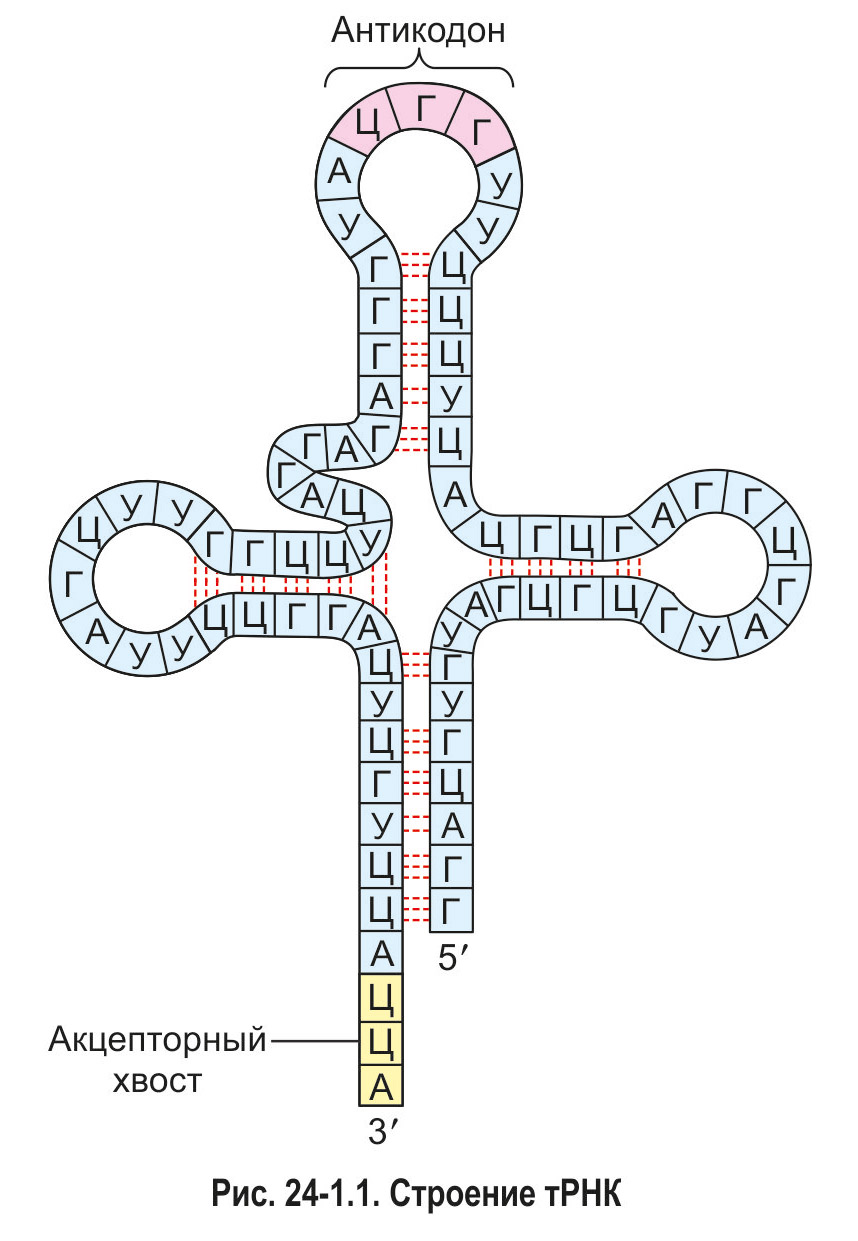 Доставка аминокислот к рибосомам проходит помощью транспортных РНК. Как вы знаете, молекулы тРНК имеют форму, напоминающую лист клевера (рис. 24-1.1). При этом *3'-конец цепи тРНК —* акцепторный хвост — служит для присоединения аминокислоты. В противоположной части молекулы тРНК имеется особый триплет — антикодон. Последовательность нуклеотидов в составе антикодона определяет, с каким именно кодоном мРНК будет комплементарно соединяться та или иная тРНК и какую аминокислоту она будет переносить. Например, тРНК, имеющая антикодон 3'УАЦ5', может связаться по принципу комплементарности только с триплетом мРНК 5'АУГ3'. Поскольку этот триплет кодирует метионин (Мет), данная тРНК служит для транспорта именно этой аминокислоты.
Доставка аминокислот к рибосомам проходит помощью транспортных РНК. Как вы знаете, молекулы тРНК имеют форму, напоминающую лист клевера (рис. 24-1.1). При этом *3'-конец цепи тРНК —* акцепторный хвост — служит для присоединения аминокислоты. В противоположной части молекулы тРНК имеется особый триплет — антикодон. Последовательность нуклеотидов в составе антикодона определяет, с каким именно кодоном мРНК будет комплементарно соединяться та или иная тРНК и какую аминокислоту она будет переносить. Например, тРНК, имеющая антикодон 3'УАЦ5', может связаться по принципу комплементарности только с триплетом мРНК 5'АУГ3'. Поскольку этот триплет кодирует метионин (Мет), данная тРНК служит для транспорта именно этой аминокислоты.
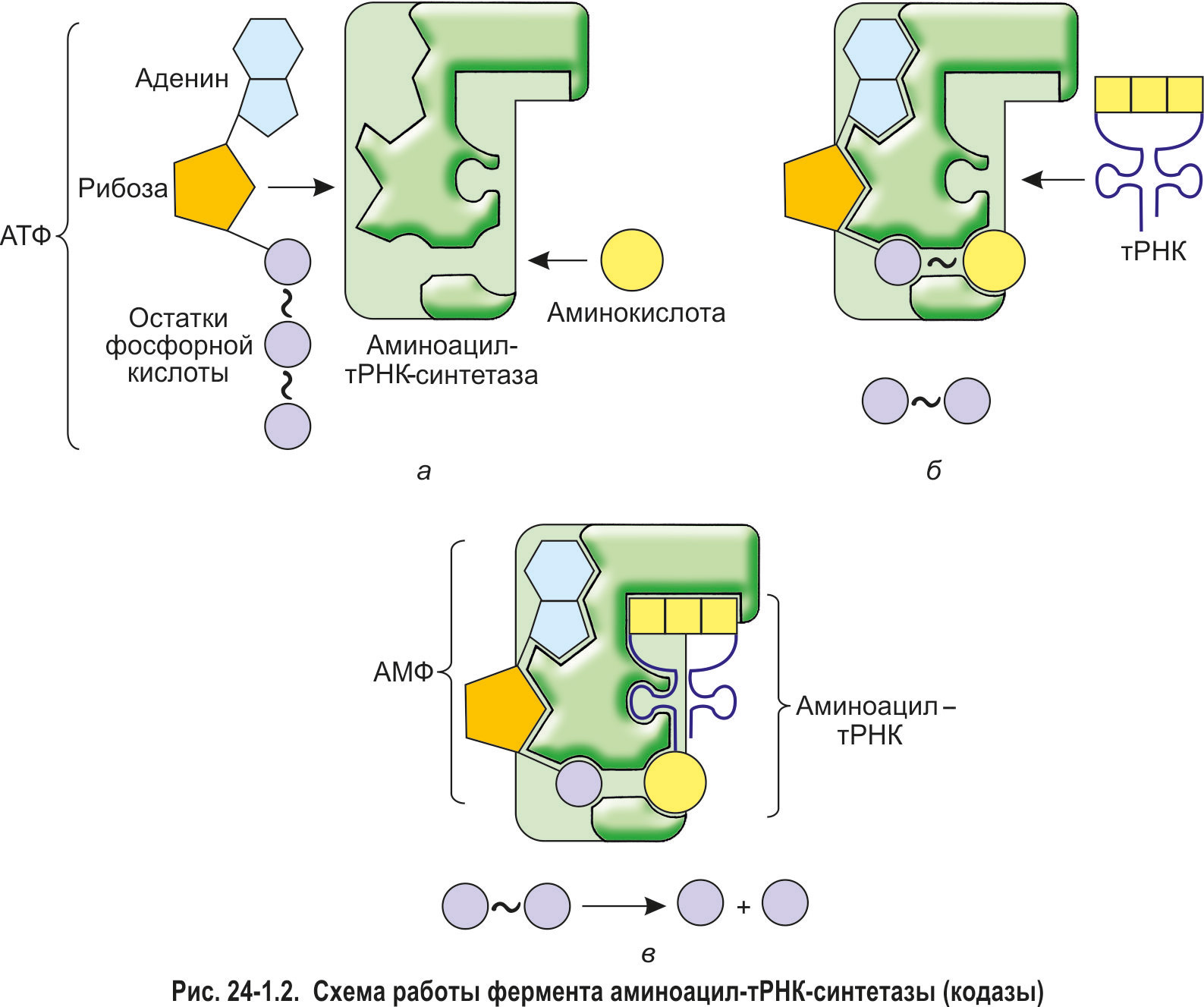
*Аминокислота способна присоединиться к акцепторному хвосту тРНК только в том случае, если она была предварительно активирована энергией, выделившейся при расщеплении одной молекулы АТФ. Активацию аминокислот и их последующее связывание с молекулами тРНК осуществляют ферменты аминоацил-тРНК-синтетазы (кодазы). При этом для каждой из 20 белокобразующих аминокислот существует особая кодаза. Она способна отличить данную аминокислоту от других аминокислот, связаться с ней, активировать и присоединить к тРНК, имеющей соответствующий антикодон.
Сначала в активный центр аминоацил-тРНК-синтетазы поступают аминокислота и молекула АТФ (рис. 24-1.2, а). Происходит расщепление АТФ до АМФ. При этом высвобождается энергия, которая идет на формирование макроэргической связи между аминокислотой и АМФ. Образуется богатый энергией комплекс «аминокислота~АМФ», аминокислота в его составе уже активирована. Это значит, что она обладает запасом энергии для того, чтобы присоединиться к тРНК, а затем, уже в рибосоме, образовать пептидную связь с другой аминокислотой.
Далее с активным центром кодазы связывается молекула тРНК (рис. 24-1.2, б). Активированная аминокислота отрывается от АМФ и присоединяется к акцепторному хвосту тРНК (рис. 24-1.2, в). АМФ и соединение «аминокислота—тРНК» (аминоацил-тРНК) покидают активный центр кодазы. Описанные процессы можно выразить суммарным уравнением (для упрощения не указаны молекулы воды, необходимые для гидролиза АТФ):
*
*Образовавшиеся аминоацил-тРНК транспортируются к рибосомам, где и происходит трансляция. Синтез белков у прокариот и эукариот осуществляется сходным образом, основными этапами трансляции являются инициация, элонгация и терминация. Рассмотрим эти этапы на примере синтеза белка в эукариотической клетке.
1. Инициация. К малой субъединице рибосомы присоединяется мРНК. Как вы знаете, 5'-конец этой молекулы содержит особую нуклеотидную последовательность, необходимую для правильного связывания с рибосомой. Поэтому прикрепление мРНК к малой субъединице происходит именно в области 5'-конца вблизи стартового кодона АУГ. Этот триплет кодирует аминокислоту метионин.
К стартовому кодону с помощью своего антикодона комплементарно присоединяется тРНК, несущая метионин, — так называемая инициаторная тРНК. Поскольку синтез белка начинается с триплета АУГ, практически все белки, образующиеся в ходе трансляции (за редким исключением), начинаются с остатка метионина. Позднее у большинства белков происходит отщепление этого остатка.
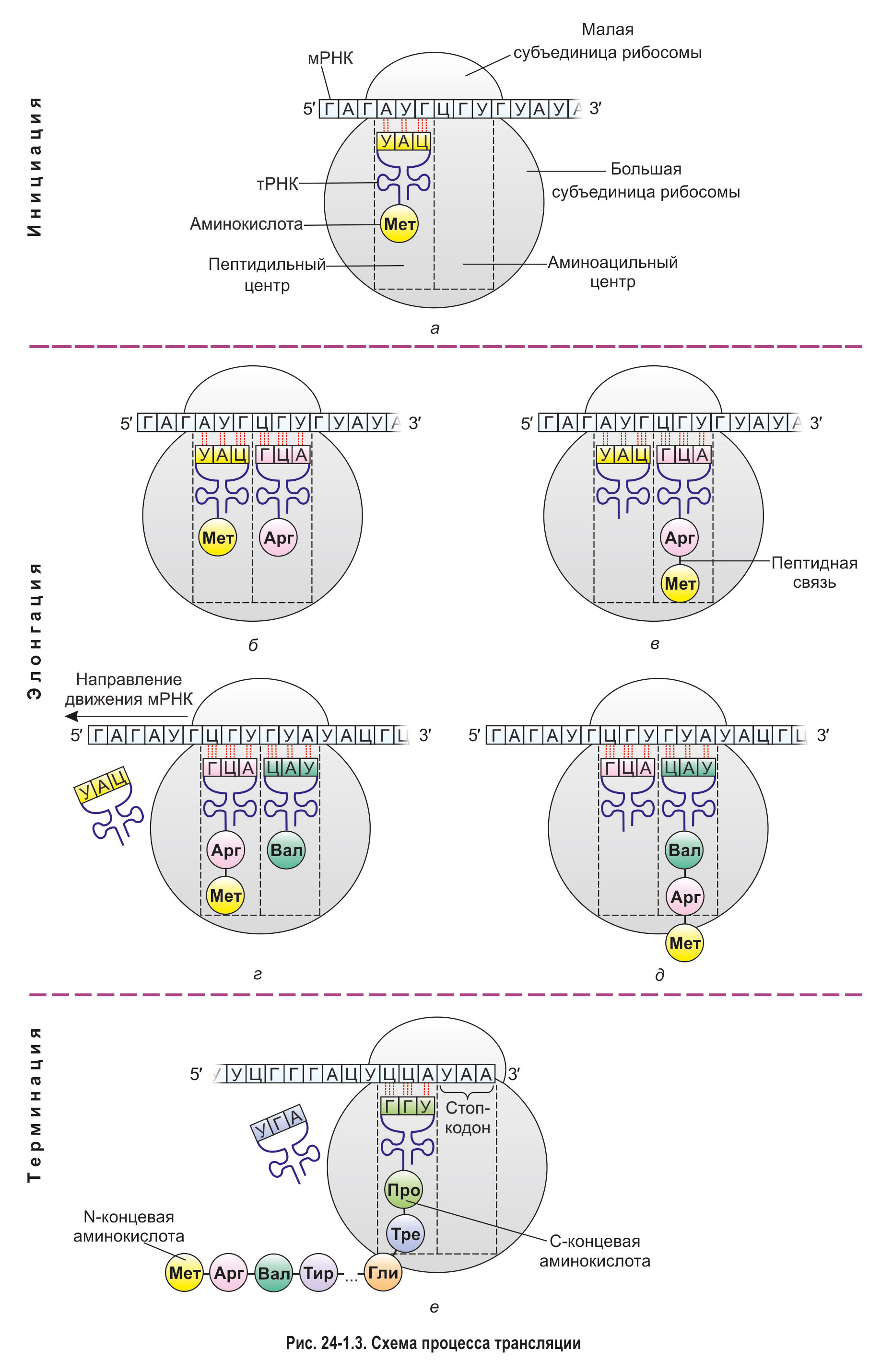 После связывания инициаторной тРНК к образовавшемуся комплексу присоединяется большая субъединица рибосомы (рис. 24-1.3, а). В ней имеются два особых участка — пептидильный центр (П-центр) и аминоацильный центр (А-центр). Прикрепление большой субъединицы происходит таким образом, что в П-центре оказывается инициаторная тРНК, связанная со стартовым кодоном, а в А-центре — второй кодон (тот, который следует непосредственно за стартовым).
После связывания инициаторной тРНК к образовавшемуся комплексу присоединяется большая субъединица рибосомы (рис. 24-1.3, а). В ней имеются два особых участка — пептидильный центр (П-центр) и аминоацильный центр (А-центр). Прикрепление большой субъединицы происходит таким образом, что в П-центре оказывается инициаторная тРНК, связанная со стартовым кодоном, а в А-центре — второй кодон (тот, который следует непосредственно за стартовым).
2. Элонгация. В аминоацильный центр поступает тРНК, принесшая вторую аминокислоту, и благодаря своему антикодону комплементарно связывается со вторым кодоном мРНК (рис. 24-1.3, б). Затем первая аминокислота (метионин) отщепляется от инициаторной тРНК и переносится из П-центра ко второй аминокислоте, находящейся в А-центре. Между двумя аминокислотами возникает пептидная связь (рис. 24-1.3, в). Подобный перенос и образование пептидной связи катализирует не один из рибосомальных белков, а молекула рРНК, т. е. рибозим.
Далее специальный белок сдвигает мРНК на один триплет (рис. 24-1.3, г). Вместе с мРНК смещаются и связанные с ней транспортные РНК. При этом первая тРНК выходит из П-центра, отделяется от молекулы мРНК и покидает рибосому. Вторая тРНК, соединенная с дипептидом, перемещается из А-центра в П-центр и занимает место первой.
В освободившийся А-центр поступает следующая аминоацил-тРНК и за счет антикодона комплементарно связывается с третьим кодоном мРНК. После этого происходит перенос образованного ранее дипептида из пептидильного центра в аминоацильный и его присоединение к третьей аминокислоте (рис. 24-1.3, д). Затем мРНК и связанные с ней тРНК сдвигаются еще на один триплет.
Описанная выше последовательность процессов (перенос пептида → образование новой пептидной связи → сдвиг мРНК) многократно повторяется. Так происходит наращивание полипептидной цепи. При этом считывание информации с мРНК происходит в направлении 5' → 3', а синтез белковой молекулы — от N-конца к С-концу. Это значит, что в составе полипептида остаток первой аминокислоты имеет свободную аминогруппу, а последний аминокислотный остаток — карбоксильную.*
*Доказательством того, что включение аминокислоты в состав белка зависит не от самой аминокислоты, а от взаимодействия принесшей ее тРНК с молекулой мРНК, может служить следующий эксперимент. С триплетом УГУ, кодирующим аминокислоту цистеин, может комплементарно связаться только тРНК, имеющая антикодон АЦА. В норме эта тРНК транспортирует цистеин. В опыте комплекс «цистеин—тРНК» подвергали воздействию особого катализатора, превращающего цистеин в другую аминокислоту — аланин. Полученный комплекс транспортировал аланин, однако антикодон тРНК соответствовал цистеину. Участие таких модифицированных аминоацил-тРНК в трансляции приводило к тому, что в составе белка позиции, которые кодировались триплетом УГУ, занимал не цистеин, а аланин. Таким образом, ключевую роль в механизме синтеза белка играет не природа аминокислот как таковая, а комплементарное связывание антикодонов тРНК с соответствующими кодонами мРНК.*
*3. Терминация. Биосинтез белка продолжается до тех пор, пока в аминоацильный центр рибосомы не попадет один из стоп-кодонов мРНК — УАА, УАГ или УГА (рис. 24-1.3, е). В клетках не существуют тРНК, антикодоны которых соответствовали бы этим кодонам. Следовательно, в А-центре не может закрепиться ни одна молекула тРНК, из-за чего процесс трансляции прекращается. Происходит отделение от рибосомы молекулы мРНК и синтезированной полипептидной цепи. Рибосома при этом, как правило, распадается на две отдельные субъединицы.
Следует отметить, что для протекания трансляции нужны не только рибосома, мРНК и различные аминоацил-тРНК. В этом процессе также участвуют особые белки — так называемые факторы инициации, элонгации и терминации. Поставщиками энергии для синтеза белка служат макроэргические соединения АТФ и ГТФ. Для образования каждой пептидной связи необходимо разорвать четыре макроэргические. Две из них разрываются при расщеплении молекулы АТФ до АМФ в ходе активации аминокислоты. Еще две макроэргические связи разрушаются при гидролизе двух молекул ГТФ до ГДФ в каждом цикле элонгации.*
Синтез белков в клетках осуществляется быстро. Установлено, что за 1 мин в рибосоме образуются приблизительно 5—6 тыс пептидных связей. Таким образом, время синтеза небольших белковых молекул исчисляется секундами, а на образование крупных, содержащих по нескольку тысяч аминокислотных остатков уходит около минуты.
В организме человека массой 70 кг содержится примерно 10 кг белков. При этом ежедневно около 300—400 г белков, входящих в состав клеток и тканей, расщепляется до аминокислот и приблизительно такое же количество аминокислот включается во вновь синтезированные белковые молекулы. Это значит, что все белки организма обновляются в среднем за 30 дней.
*Однако на самом деле скорость ресинтеза белков в различных органах и тканях неодинакова. Например, почти все белки плазмы крови человека, а также около половины белков, входящих в состав печени и слизистой оболочки кишечника, обновляются за 10 сут. Сравнительно медленно происходит ресинтез белков дермы кожи, мышц, костной, хрящевой и нервной тканей. Так, 50 % мышечного белка миозина обновляется примерно за 180 дней.*
По мере продвижения мРНК через рибосому с ее освободившимся 5'-концом может связываться следующая рибосома. Благодаря этому на одной молекуле мРНК могут одновременно находиться несколько рибосом, синтезирующих с небольшой разбежкой во времени идентичные молекулы белка. Такие комплексы рибосом, связанные одной молекулой мРНК, называются полисомами.
Таким образом, генетическая информация, которая содержится в ДНК, в результате процессов транскрипции и трансляции реализуется в виде молекул белков. Синтез белка обеспечивается взаимодействием различных видов РНК. Рибосомные РНК являются главным структурным компонентом рибосом, *некоторые из них катализируют реакции синтеза белка*. Матричная РНК — носитель информации о первичной структуре белка. Транспортные РНК доставляют в рибосому аминокислоты.
Биосинтез РНК (транскрипция) и биосинтез белка (трансляция) осуществляются с использованием матриц — ДНК и мРНК соответственно. Поэтому, так же как и репликация, процессы транскрипции и трансляции являются реакциями матричного синтеза.