§ 35. Электрычны ток у электралітах
Пры вывучэнні папярэдняга параграфа вы даведаліся, што ў металах перанос зараду не суправаджаецца пераносам рэчыва, а носьбітамі свабодных зарадаў з’яўляюцца электроны. Але існуе клас праваднікоў, праходжанне электрычнага току ў якіх заўсёды суправаджаецца хімічнымі зменамі і пераносам рэчыва. Якая прырода электрычнага току ў такіх правадніках?
Прырода электрычнага току ў электралітах. З доследаў вынікае, што растворы многіх солей, кіслот і шчолачаў, а таксама расплавы солей і аксідаў металаў праводзяць электрычны ток, гэта значыць з’яўляюцца праваднікамі. Такія праваднікі назвалі электралітамі.
Электраліты — рэчывы, растворы або расплавы якіх праводзяць электрычны ток.
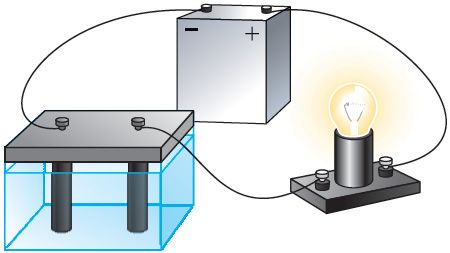
Правядзём дослед. Збяром электрычны ланцуг, які складаецца з крыніцы току, лямпы напальвання і ванны з дыстыляванай вадой, у якой знаходзяцца два вугальныя электроды. Пры замыканні ланцуга лямпа не свеціцца, значыць, дыстыляваная вада не праводзіць электрычны ток. Паўторым дослед, дадаўшы ў дыстыляваную ваду цукар. Лямпа не свеціцца і ў гэтым выпадку. Раствор цукру ў вадзе таксама не з’яўляецца правадніком. А цяпер дададзім у дыстыляваную ваду невялікую колькасць солі, напрыклад хларыду медзі(II) CuCl2. У ланцугу праходзіць электрычны ток, пра што наглядна сведчыць свячэнне лямпы (мал. 200). Такім чынам, раствор солі ў вадзе з’яўляецца правадніком электрычнага току, гэта значыць пры растварэнні хларыду медзі(II) у дыстыляванай вадзе з’явіліся свабодныя носьбіты электрычнага зараду.
Вывучаючы хімію, вы даведаліся, што пры растварэнні солей, кіслот і шчолачаў у вадзе адбываецца электралітычная дысацыяцыя, гэта значыць распад малекул электраліту на іоны. У праведзеным доследзе хларыд медзі(II) CuCl2 у водным растворы дысацыіруе на дадатна зараджаныя іоны медзі Cu2+ і адмоўна зараджаныя іоны хлору Cl–.
![]()
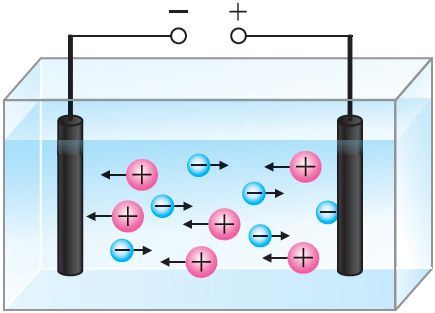
Іоны Cu2+ і Cl– у растворы пры адсутнасці электрычнага поля рухаюцца хаатычна. Пад дзеяннем знешняга электрычнага поля на хаатычны рух іонаў накладваецца іх накіраваны рух (мал. 201). Пры гэтым дадатна зараджаныя іоны Cu2+ рухаюцца да катода (электрода, які падключаны да адмоўнага полюса крыніцы току), адмоўна зараджаныя іоны Cl– — да анода (электрода, які падключаны да дадатнага полюса крыніцы току). На анодзе будзе адбывацца працэс акіслення іонаў Cl– да атамаў.
Атамы ўтвараюць малекулы хлору, якія выдзяляюцца на анодзе.
На катодзе будзе адбывацца працэс аднаўлення іонаў Cu2+ да атамаў і асаджэнне медзі.
Гэтую з’яву называюць электролізам.
Электроліз — працэс выдзялення на электродах састаўных частак раствораных рэчываў, звязаны з акісляльна-аднаўленчымі рэакцыямі, што адбываюцца пры праходжанні электрычнага току праз растворы (расплавы) электралітаў або іншых рэчываў, якія з’яўляюцца вынікам другасных рэакцый.
Такім чынам, свабодныя носьбіты электрычнага зараду ў электралітах — дадатна і адмоўна зараджаныя іоны, якія ўтвараюцца ў выніку электралітычнай дысацыяцыі, а праводнасць электралітаў з’яўляецца іоннай. Электраліты адносяць да праваднікоў другога роду.
Чаму небяспечна дакранацца неахаванымі ўчасткамі цела чалавека да неізаляваных металічных правадоў, па якіх праходзіць электрычны ток?
![]()
