§ 14. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам изменения состояния идеального газа
![]()
Адиабатный процесс. Адиабатным называют процесс, в ходе которого термодинамическая система не получает и не отдаёт энергию путём теплообмена. Таким образом, при адиабатном процессе:
Q = 0.
Применяя к этому процессу первый закон термодинамики, получим:
ΔU = −A , или A = −ΔU.
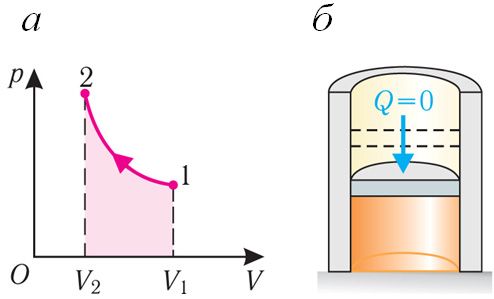
При адиабатном процессе изменение внутренней энергии системы происходит только за счёт совершения работы. Если внешние силы совершают работу по сжатию газа (ΔV < 0, А < 0) (рис. 80.2, а, б), то внутренняя энергия газа увеличивается (ΔU > 0), газ нагревается.
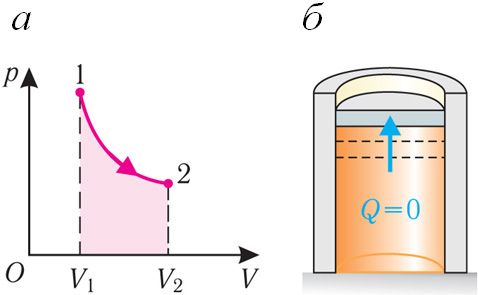
Если сила давления газа совершает работу по расширению (ΔV > 0, А > 0) (рис. 80.3, а, б), то внутренняя энергия газа уменьшается (ΔU < 0), газ охлаждается.
1. При адиабатном расширении силой давления идеального газа совершена работа А = 265 Дж. Как изменилась при этом температура газа? Определите приращение внутренней энергии газа.
2. В цилиндре с подвижным поршнем находится идеальный газ, давление которого р1 и объём V1. В каком случае сила давления газа совершит большую работу: при изотермическом или адиабатном его расширении до объёма V2?
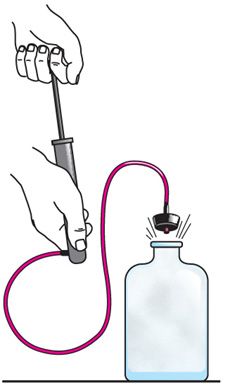
На практике адиабатный процесс осуществляют главным образом не за счёт теплоизоляции (нельзя окружить систему оболочкой, которая абсолютно не допускает теплообмена), а за счёт скорости протекания процесса. Если процесс протекает очень быстро, то теплообмен практически не проявляется. Очень нагляден опыт, иллюстрирующий уменьшение температуры газа при его адиабатном расширении. Если, используя насос, через отверстие в пробке накачивать в стеклянный сосуд воздух (рис. 80.4), то через некоторый промежуток времени сила давления сжатого воздуха совершит работу по преодолению силы трения, которой сосуд действует на пробку, и силы атмосферного давления. Теплообмен между сосудом и окружающими телами не успевает проявиться за тот малый промежуток времени, в течение которого пробка вылетает из сосуда и часть газа выходит из него. Уменьшение внутренней энергии воздуха в сосуде обусловлено не только уменьшением массы, но и понижением его температуры, что приводит к конденсации водяных паров, т. е. к образованию тумана.
Примером адиабатного процесса может служить охлаждение воздуха в атмосфере. Нагретый возле поверхности земли воздух при быстром подъёме в верхние слои атмосферы расширяется почти адиабатно и при этом существенно охлаждается. Водяной пар в нём конденсируется в маленькие капли воды и кристаллики льда, образуя облака. Процесс, близкий к адиабатному, используют в двигателях внутреннего сгорания.
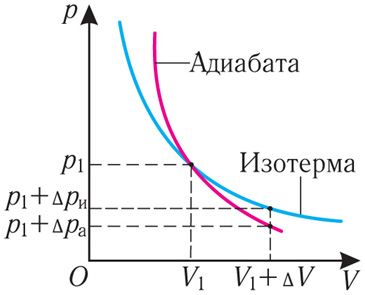
График адиабатного процесса в координатах (p, V) похож на график изотермического процесса (рис. 80.5). Однако одному и тому же изменению объёма ΔV при адиабатном процессе соответствует большее изменение давления, чем при изотермическом: . Это объясняется тем, что в случае адиабатного расширения давление p = nkT уменьшается не только за счёт увеличения объёма газа (и уменьшения концентрации частиц), но и за счёт уменьшения температуры. При изотермическом расширении давление газа уменьшается только за счёт уменьшения концентрации частиц.

1. Приведите две формулировки первого закона термодинамики.
2. Чему равно изменение внутренней энергии при изохорном процессе?
3. На что расходуется количество теплоты, сообщаемое системе при изотермическом процессе?
4. На что расходуется количество теплоты, сообщаемое системе при изобарном процессе?
5. При быстром сжатии газа произошло повышение его температуры. Означает ли это, что газу сообщили некоторое количество теплоты? Можно ли утверждать, что внутренняя энергия газа увеличилась?
![]()
6. Почему невозможно создать «вечный двигатель первого рода»?
7. Можно ли передать газу некоторое количество энергии путём теплообмена, не вызывая при этом повышения его температуры? Приведите примеры.
8. Какой процесс изменения состояния газа называют адиабатным? Как этот процесс можно осуществить?
9. В § 12 мы утверждали, что работа, совершаемая при переходе системы из одного состояния в другое, является функцией процесса, т. е. зависит не только от начального и конечного состояний, но и от вида процесса. Используя первый закон термодинамики, докажите, что количество теплоты, получаемое или отдаваемое системой при её переходе из одного состояния в другое, также является функцией процесса.
10. Заполните таблицу в тетради.
| Процесс | Работа силы давления газа | Количество теплоты | Изменение внутренней энергии | Вывод |
| Изохорный (V = const и ΔV = 0) | ||||
| Изотермический (Т = const и ΔТ = 0) | ||||
| Изобарный (р = const) | ||||
| Адиабатный (ΔU = −A) |