*§ 15-1. Присоединение галогеноводородов и воды к алкенам. Правило Марковникова
Правило Марковникова
Правило Марковникова
Реакции присоединения галогеноводородов и воды к гомологам этилена имеют некоторые особенности.
Присоединение галогеноводородов. Гидрогалогенирование
Рассмотрим реакцию присоединения хлороводорода к пропену. В результате этой реакции, в принципе, возможно образование двух продуктов — 2-хлорпропана и 1-хлорпропана:
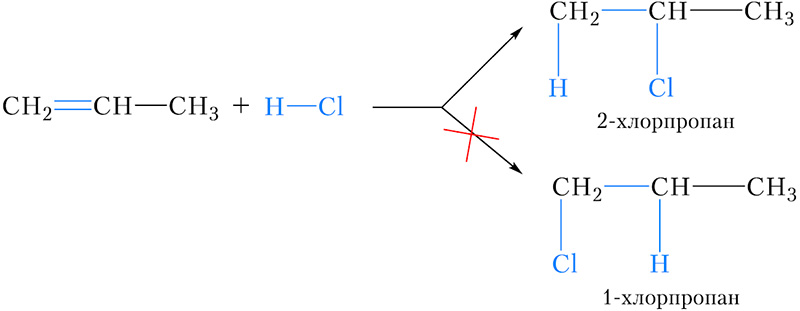
В действительности, преимущественным продуктом этой реакции является 2-хлорпропан.
То же явление (образование одного из двух возможных продуктов) наблюдается при присоединении хлороводорода к метилпропену:
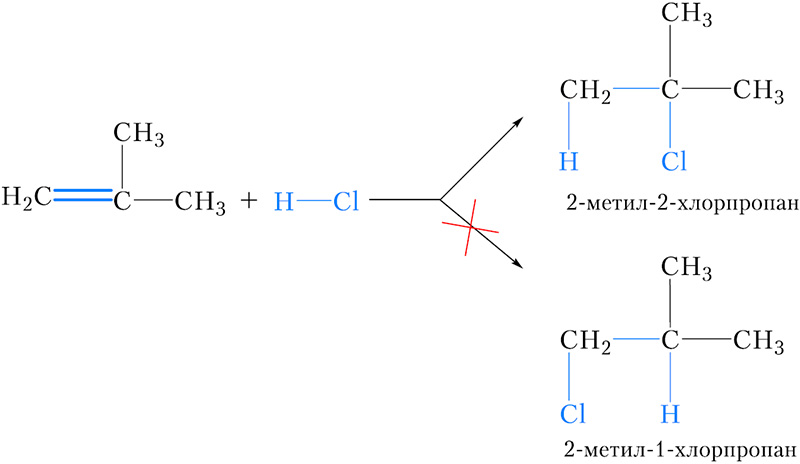
Можно заметить, что в обоих случаях водород присоединяется к тому атому углерода двойной связи, с которым соединено большее число атомов водорода (более гидрогенизированному атому углерода). Эта закономерность называется правилом Марковникова.
В качестве ещё одной иллюстрации правила Марковникова запишем уравнение реакции присоединения хлороводорода к метилбутену-2:
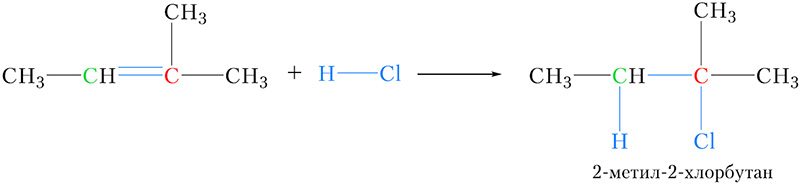
Атом углерода, выделенный зелёным цветом, соединён с одним атомом водорода, в то время как у другого атома углерода двойной связи (выделен красным цветом) атомы водорода отсутствуют. В соответствии с правилом Марковникова водород присоединяется к более гидрогенизированному атому углерода.
Присоединение воды. Гидратация
Присоединение воды к пропену и другим несимметричным алкенам также протекает в соответствии с правилом Марковникова:
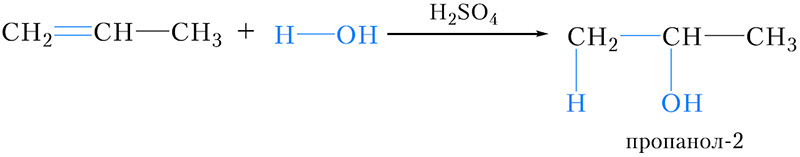
Правило Марковникова. При присоединении галогеноводородов и воды к алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.

Интересно знать
Правило Марковникова носит имя его первооткрывателя — русского химика Владимира Васильевича Марковникова, ученика А. М. Бутлерова. В. В. Марковников внёс значительный вклад в развитие положений теории строения органических соединений, касающихся изомерии и взаимного влияния атомов в молекулах органических веществ. В. В. Марковников открыл циклоалканы в составе кавказских нефтей, известны его работы по исследованию состава соляных источников и соляных озер России.
Объяснение правила Марковникова. Электронодонорные и электроноакцепторные заместители
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. По этому признаку все заместители можно разделить на две группы:
1. Заместители, которые притягивают электроны π-связи. Такие заместители называются электроноакцепторными (от англ. to accept — принимать). Примеры электроноакцепторных заместителей: карбоксильная группа ![]() COOH и нитрогруппа
COOH и нитрогруппа ![]() NO2. Смещение электронов π-связи под действием электроноакцепторного заместителя показано на рисунке 15-1.2:
NO2. Смещение электронов π-связи под действием электроноакцепторного заместителя показано на рисунке 15-1.2:

 С под действием электроноакцепторного заместителя
С под действием электроноакцепторного заместителя 2. Заместители, которые отталкивают электроны π-связи (электронодонорные заместители). К электронодонорным заместителям относятся алкильные радикалы ![]() CH3,
CH3, ![]() C2H5 и др., гидроксильная группа
C2H5 и др., гидроксильная группа ![]() OH и аминогруппа
OH и аминогруппа ![]() NH2. Смещение электронов π-связи под действием электронодонорного заместителя показано на рисунке 15-1.3:
NH2. Смещение электронов π-связи под действием электронодонорного заместителя показано на рисунке 15-1.3:

 С под действием электронодонорного заместителя
С под действием электронодонорного заместителя Рассмотрим присоединение хлороводорода к пропену с учётом влияния заместителей на электроны π-связи:
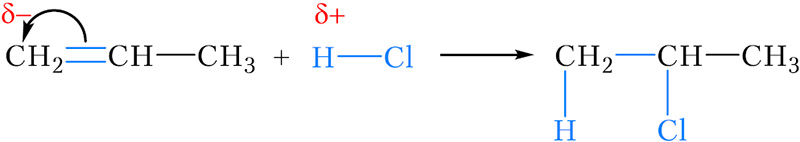
Положительно заряженный атом водорода молекулы хлороводорода присоединяется к атому углерода двойной связи, несущему отрицательный заряд. Этим атомом углерода является более гидрогенизированный атом C(1), что соответствует правилу Марковникова.
Присоединение галогеноводородов и воды к несимметричным алкенам протекает по правилу Марковникова — водород присоединяется к более гидрогенизированному атому углерода двойной связи.
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. Электроноакцепторные заместители (![]() COOH,
COOH, ![]() NO2) притягивают электроны π-связи, электронодонорные (алкильные радикалы,
NO2) притягивают электроны π-связи, электронодонорные (алкильные радикалы, ![]() OH,
OH, ![]() NH2) – отталкивают.
NH2) – отталкивают.