§ 1. Хімія. Рэчыва, хімічны элемент, атам
У параграфе прыведзены раней вывучаныя паняцці і азначэнні: што такое хімія, рэчыва, яго фізічныя ўласцівасці, хімічны элемент, атам, яго маса, памер, іоны, малекулы, а таксама нагадваецца аб тым, як разлічыць масавую долю рэчыва ў сумесі і аб’ёмную долю газу ў сумесі. Гэты матэрыял прыведзены для паўтарэння ў сістэматызаваным выглядзе.
Хімія — навука, якая вывучае рэчывы, іх састаў, будову, уласцівасці, хімічныя ператварэнні адных рэчываў у іншыя.
Хімію як навуку падзяляюць на шэраг галін: неарганічную, арганічную, біяарганічную, аналітычную, фізічную, фармацэўтычную хімію, нанахімію і інш. Адрозненне ў галінах вызначаецца прыродай рэчываў, што вывучаюцца, і іх ператварэнняў, а таксама характарам задач, якія вырашаюцца.
Падкрэсліваючы спецыфіку сваіх даследаванняў, хімікі ўвялі паняцце «хімічнае рэчыва», хоць гэтае словазлучэнне часта спрашчаюць і называюць проста «рэчыва».
Хімічнае рэчыва — гэта ўстойлівая сістэма часціц (атамаў, іонаў або малекул), якая валодае пэўнымі фізічнымі і хімічнымі ўласцівасцямі.
Якасны і колькасны састаў індывідуальных хімічных рэчываў запісваюць у выглядзе хімічных формул, напрыклад: H2O — вада, MgSO4 — сульфат магнію, N2 — азот, Na — натрый, NaCl — хларыд натрыю.
Хімічная формула — гэта ўмоўны запіс саставу рэчываў з дапамогай сімвалаў хімічных элементаў і лікавых індэксаў.
Да фізічных уласцівасцей рэчыва адносяць колер, шчыльнасць, цвёрдасць, тэмпературы плаўлення і кіпення і іншыя характарыстыкі, якія, як правіла, выражаюцца з дапамогай вымяральных велічынь. Так, ёд можна ахарактарызаваць наступным чынам: крышталічнае пры пакаёвай тэмпературы рэчыва цёмна-фіялетавага колеру з металічным бляскам, мала растваральнае ў вадзе, тэмпература яго кіпення роўная 184,4 °С , плаўлення — 113,5 °С, шчыльнасць складае 4,9 г/см3.
Хімічныя ўласцівасці рэчываў — гэта іх здольнасць ператварацца ў іншыя рэчывы пад уздзеяннем тэмпературы, ціску, выпраменьвання або іншых рэчываў.
Так, карбанат кальцыю пад уздзеяннем тэмпературы (а не іншых рэчываў) ператвараецца ў аксід кальцыю і вуглякіслы газ:
а аксід медзі(II), уступаючы ва ўзаемадзеянне з сернай кіслатой, утварае соль — cульфат медзі(II):
Атам — гэта электранейтральная часціца, якая складаецца з дадатна зараджанага ядра і адмоўна зараджаных электронаў.
Сукупнасць атамаў з аднолькавым зарадам ядра называюць хімічным элементам.
Сімвалы хімічных элементаў прыведзены ў перыядычнай сістэме хімічных элементаў Д. І. Мендзялеева. Як вам вядома, парадкавы (атамны) нумар хімічнага элемента ў перыядычнай сістэме Д. І. Мендзялеева адпавядае адноснаму зараду ядра (Z). Так, парадкавы нумар 8 адпавядае адноснаму зараду ядра атама кіслароду +8, а ядро з адносным зарадам +13 мае атам алюмінію.
Атамы розных хімічных элементаў адрозніваюцца не толькі зарадам ядра, але і масай, памерам, будовай.
Маса атама (ma), як і маса іншых аб’ектаў, можа выражацца ў адзінках масы сістэмы СІ — кілаграмах, напрыклад:
Значна зручней карыстацца шкалой адносных адзінак. Для характарыстыкі масы атамаў і іншых мікрачасціц у хіміі выкарыстоўваюць атамную адзінку масы — 1 а. а м., роўную часткі масы атама вугляроду-12. Замест беларускага абазначэння атамнай адзінкі масы (1 а. а м.) часта прыводзяць яе міжнароднае абазначэнне 1 u (unit). Маса 1 u складае:
Параўноўваючы масы атамаў з 1 u, атрымліваюць безразмерную велічыню, якую называюць адноснай атамнай масай і абазначаюць сімвалам Ar (дзе r — пачатковая літара лацінскага слова relativus — адносны):
Адносная атамная маса элемента — фізічная велічыня, роўная адносінам усярэдненай масы атамаў дадзенага элемента да часткі масы атама вугляроду-12 (12С).
Адносныя атамныя масы выкарыстоўваюць у хіміі пры правядзенні разлікаў і супастаўленняў; іх значэнні прыведзены ў перыядычнай сістэме хімічных элементаў. Для разліку масы атамаў або іх адносных атамных мас можна карыстацца формуламі:
Памер атама часта характарызуюць велічынёй «радыус атама» (ra). Гэта велічыня парадку дзясятых і сотых долей нанаметра. Так, радыус найменшага па памерах атама гелію роўны 3 ∙ 10–11 м, або 0,03 нм.
Будова атама вызначае састаў і ўласцівасці ўтвораных імі рэчываў, што будзе падрабязна разглядацца ў раздзелах II і III.
Пры ўтварэнні хімічнага рэчыва як устойлівай сістэмы часціц атамы могуць аддаваць ці далучаць электроны, ператвараючыся ў іоны. Пры аддачы электронаў утвараюцца дадатна зараджаныя часціцы — катыёны, пры далучэнні электронаў атрымліваюцца адмоўна зараджаныя часціцы — аніёны. Шэраг хімічных рэчываў складаецца з катыёнаў і аніёнаў, аб’яднаных сіламі кулонаўскага ўзаемадзеяння.
Атамы могуць аб’ядноўвацца ва ўстойлівыя сістэмы таксама шляхам абагульнення электронаў з суседнімі атамамі з утварэннем незараджаных адзінак — малекул, здольных праяўляць хімічныя ўласцівасці ўсяго рэчыва. Больш падрабязна матэрыял аб рэчывах малекулярнай будовы прадстаўлены ў наступным параграфе, а звесткі пра будову рэчываў — у раздзеле III.
Важна разумець, што толькі ўстойлівая сістэма атамаў, або іонаў, або малекул з’яўляецца хімічным рэчывам, гэта значыць валодае і фізічнымі, і хімічнымі ўласцівасцямі. Для адной часціцы, напрыклад малекулы ёду, сульфід-іона або атама вугляроду, не мае сэнсу весці размову аб тэмпературы кіпення, плаўлення або агрэгатным стане.
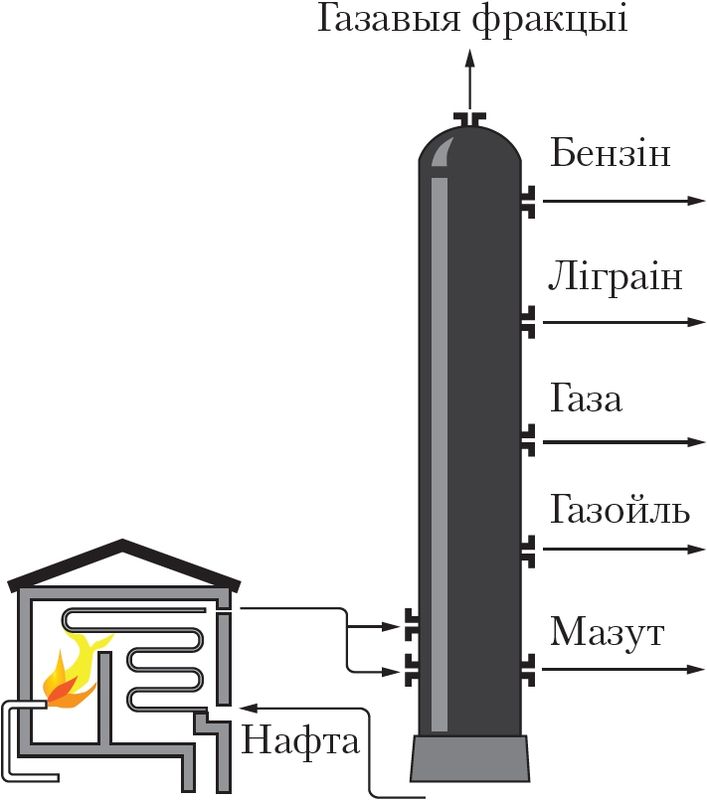
Для кожнага рэчыва характэрны свой набор уласцівасцей. Нават малая колькасць прымесей можа істотна змяніць гэтыя ўласцівасці. У прыродзе рэчывы звычайна знаходзяцца ў сумесі з іншымі рэчывамі. Таму для практычнага выкарыстання або правядзення даследаванняў рэчыва неабходна атрымаць яго ў чыстым выглядзе, гэта значыць вылучыць з сумесі, ачысціць ад прымесей. З гэтай мэтай як у лабараторнай практыцы, так і ў вытворчых умовах выкарыстоўваюць розныя метады раздзелу сумесей рэчываў і іх ачысткі. Яны заснаваны на адрозненні ўласцівасцей рэчываў, якія раздзяляюцца: розныя тэмпературы плаўлення або кіпення, шчыльнасць, растваральнасць і інш. Найбольш распаўсюджаныя такія метады ачысткі, як фільтраванне (мал. 1), адстойванне (мал. 2), перакрышталізацыя, перагонка (мал. 3). Вылучыць рэчыва з раствору можна выпарваннем (мал. 4), а раздзяліць сумесь вадкіх рэчываў — рэктыфікацыяй (мал. 5).
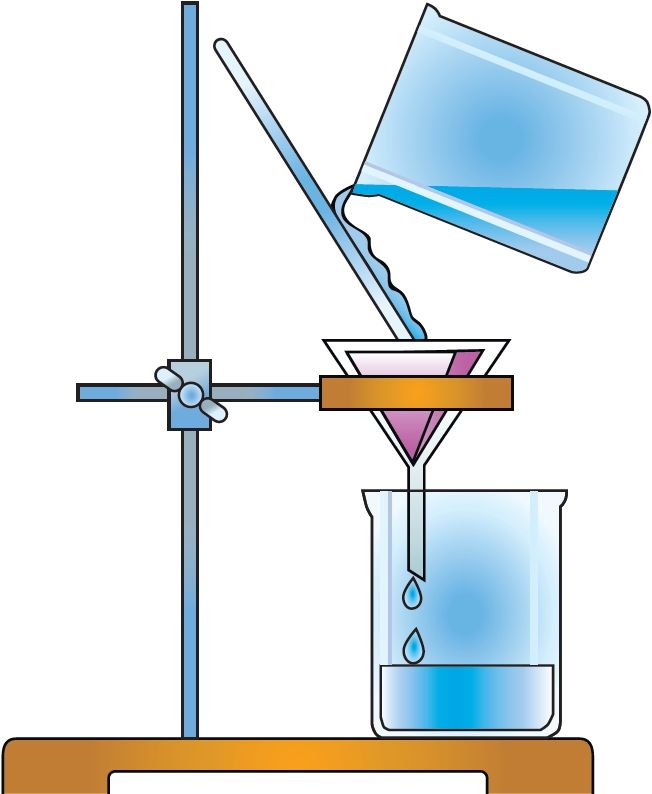
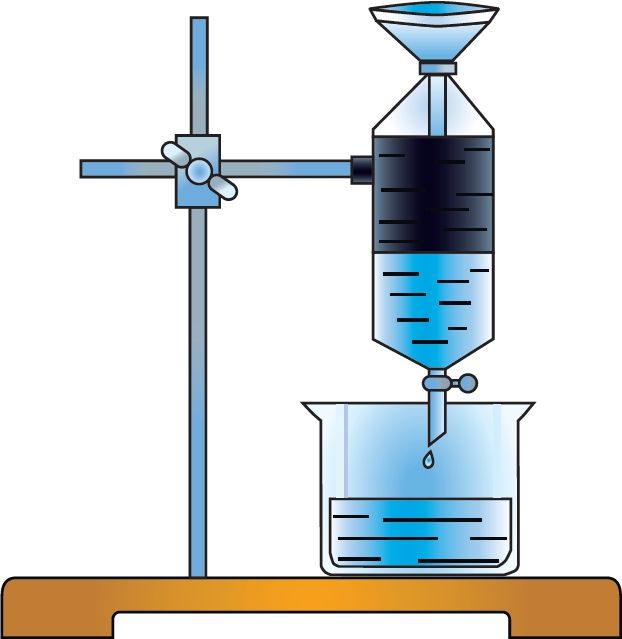
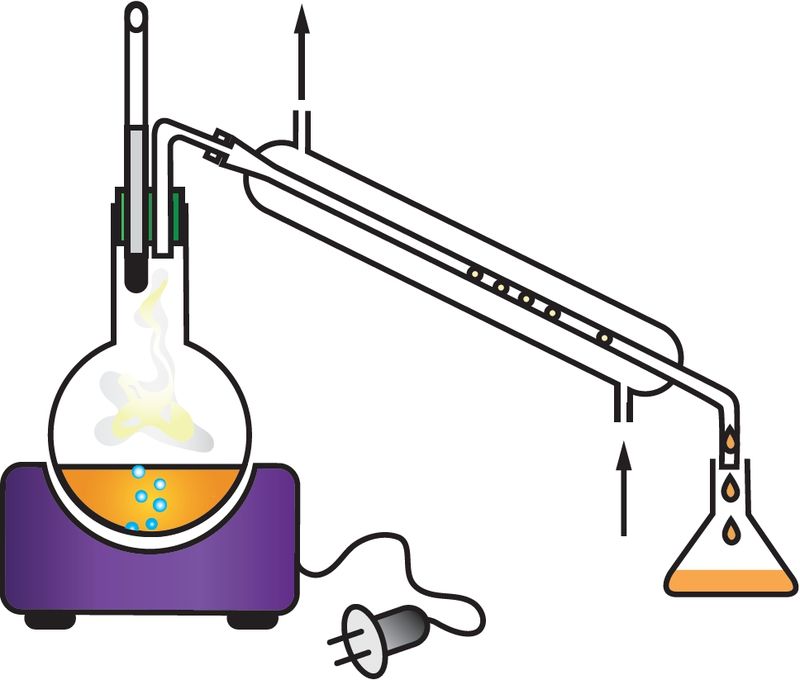
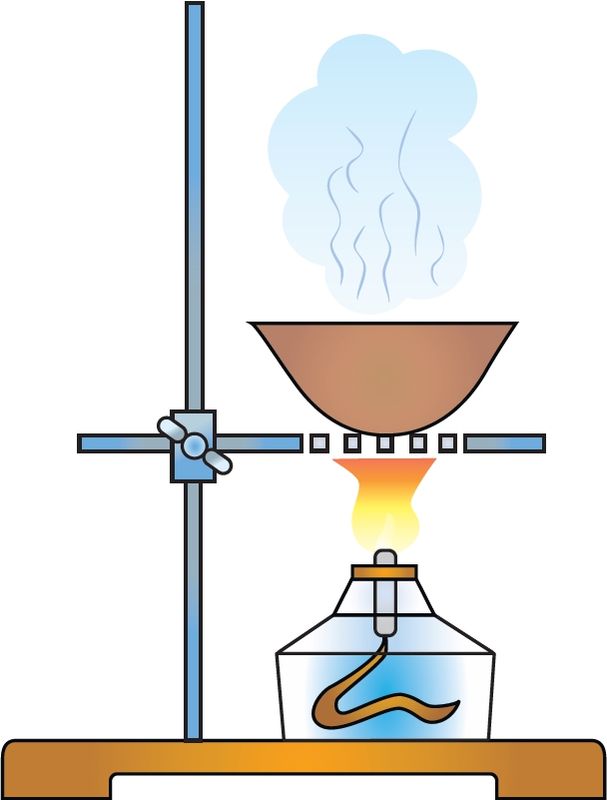
Для раздзялення газаў могуць быць выкарыстаны «малекулярныя сіты», напрыклад крышталічныя алюмасілікаты, якія характарызуюцца дакладным і аднародным памерам пор. Поры прапускаюць невялікія малекулы, але затрымліваюць буйнейшыя. Для аднаўлення актыўнасці «малекулярных сітаў» іх неабходна прагрэць або прадзьмуць газам.
Утрыманне рэчыва ў сумесі можна характарызаваць масавай і аб’ёмнай долямі.
Масавую долю рэчыва разлічваюць як адносіны масы рэчыва да масы ўсёй сумесі:
Масавая доля рэчыва — безразмерная велічыня. Найчасцей яе выражаюць у працэнтах. Для гэтага атрыманую безразмерную велічыню памнажаюць на 100.
Так, масавай доляй характарызуюць утрыманне асноўных кампанентаў у прадуктах харчавання, прымесей у хімічных рэактывах, горных пародах, угнаеннях, дзейнага рэчыва ў медыцынскіх прэпаратах і г. д. Напрыклад, масавая доля тлушчаў у малацэ складае ад 1 да 6 %, у сметанковым масле — 50–82,5 %, воцатнай кіслаты ў воцаце — 3–9 %, ёду ў спіртавым растворы — 5 %. Варта адзначыць, што масавая доля не залежыць ад велічыні порцыі сумесі, яна вызначаецца толькі суадносінамі кампанентаў сумесі.
Аб’ёмная доля газу ў сумесі. Сумесі ўтвараюць не толькі цвёрдыя або вадкія рэчывы, але і газы, таму для газаў часта разлічваюць аб’ёмную долю як адносіны аб’ёму газу да агульнага аб’ёму сумесі:
Так, утрыманне кіслароду па аб’ёме ў паветры складае 21 %, гэта значыць яго аб’ёмная доля φ(О2) = 21 % (пры гэтым яго масавая доля роўная 23 %).
Абсалютна чыстых рэчываў не бывае. Ступень чысціні рэчываў колькасна ацэньваюць масавай доляй — адносінамі масы асноўнага рэчыва (ідэальна чыстага) да масы рэальнага рэчыва з прымесямі.
Прыклад 1. Аналіз пробы залатога банкаўскага злітка масай 1,00000 г паказаў, што ў ім утрымліваецца 0,99994 г чыстага золата. Гэта азначае, што ступень чысціні такога золата складае:
Астатнія 0,006 % у гэтым злітку прыпадаюць на розныя прымесі (іншыя рэчывы).
Выбар рэчываў па чысціні вызначаецца мэтамі іх прымянення. Напрыклад, неабходная чысціня германію, які выкарыстоўваецца ў паўправадніковых прыладах, павінна складаць 99,99999999 %.