§ 12. Алкены. Строение молекул
Алкены. Строение молекул
Атомы углерода могут быть связаны между собой не только одинарными, но и двойными связями. Простейшим углеводородом, содержащим двойную связь, является этилен ![]() . Рассмотрим строение его молекулы.
. Рассмотрим строение его молекулы.
Как и в случае алканов, углерод в молекуле этилена четырёхвалентен. Образование четырёх связей происходит за счёт четырёх атомных орбиталей:
Напомним, что в молекулах изученных нами алканов каждый атом углерода находится в состоянии sp3-гибридизации (§ 7). То есть одна s- и три p-орбитали атома углерода смешиваются, образуя четыре одинаковые по форме sp3-гибридные орбитали. Эти орбитали располагаются в пространстве на максимальном удалении друг от друга под углом примерно 109°.
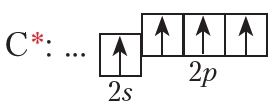
Двойная связь в молекуле этилена образуется между атомами углерода, находящимися в состоянии sp2-гибридизации. В sp2-гибридизации принимают участие: одна s- и две p-орбитали (рис. 12.1).
 Три sp2-гибридные орбитали располагаются на максимальном удалении друг от друга. Это достигается, если они находятся в одной плоскости под углом 120° (рис. 12.2).
Три sp2-гибридные орбитали располагаются на максимальном удалении друг от друга. Это достигается, если они находятся в одной плоскости под углом 120° (рис. 12.2).Одна р-орбиталь атома углерода (рис. 12.3, синего цвета) сохраняет свою первоначальную форму и располагается перпендикулярно плоскости, в которой лежат три sp2-гибридные орбитали.
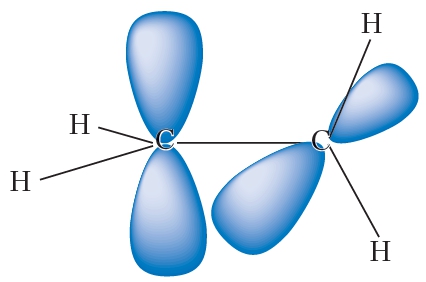
За счёт перекрывания гибридных орбиталей каждый атом углерода образует три связи — одну с соседним атомом углерода и две — с атомами водорода (рис. 12.4).
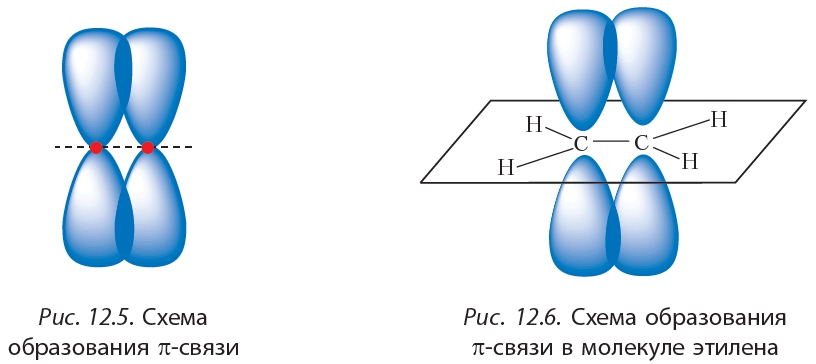
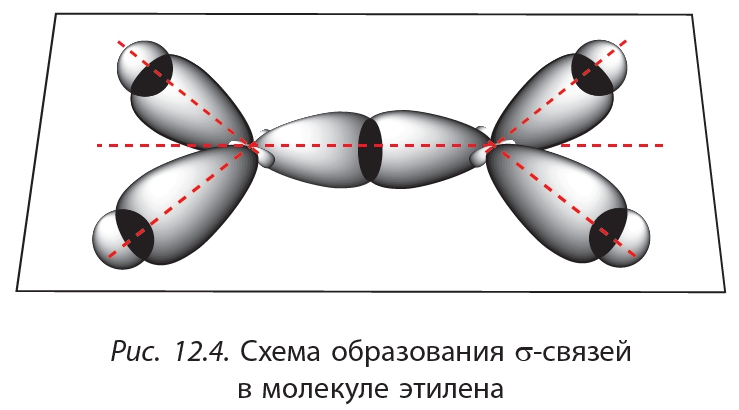 Как видно из рисунка 12.4, при образовании этих связей электронные облака перекрываются вдоль линии, соединяющей ядра атомов. Такие связи называются σ-связями (сигма-связями). Вторая связь между атомами углерода в молекуле этилена образуется за счёт бокового перекрывания негибридных р-орбиталей (12.5).
Как видно из рисунка 12.4, при образовании этих связей электронные облака перекрываются вдоль линии, соединяющей ядра атомов. Такие связи называются σ-связями (сигма-связями). Вторая связь между атомами углерода в молекуле этилена образуется за счёт бокового перекрывания негибридных р-орбиталей (12.5).Такая связь называется π-связью.
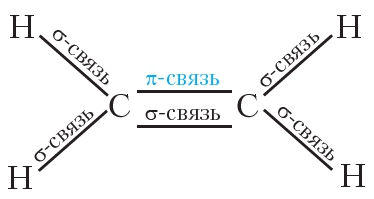
Таким образом, атомы углерода в молекуле этилена связаны двойной связью, одна из которых σ-связь, а другая — π-связь.
Все одинарные связи являются σ-связями. Двойная связь состоит из одной σ- и одной π-связи. Всего в молекуле этилена имеется пять σ-связей и одна π-связь:
Так как π-связь образуется за счёт слабого бокового перекрывания орбиталей, она менее прочная, чем σ-связь, которая образована за счёт перекрывания орбиталей, вытянутых навстречу друг другу. Тем не менее, атомы углерода, связанные двойной связью, сильнее сближаются друг с другом.
 В молекуле этилена расстояние между атомами углерода равно 0,134 нм, что заметно меньше, чем в молекуле этана (0,154 нм).
В молекуле этилена расстояние между атомами углерода равно 0,134 нм, что заметно меньше, чем в молекуле этана (0,154 нм).
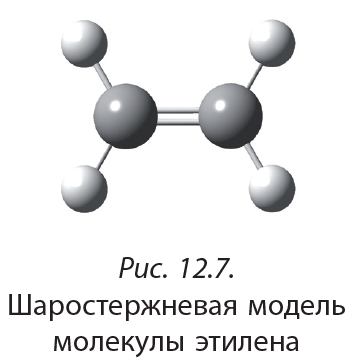
Строение молекулы этилена может быть отображено с помощью шаростержневой модели (рис. 12.7).
Молекула этилена плоская, валентные углы примерно равны 120°. В плоскости молекулы располагается система σ-связей, а π-связь образуется в результате перекрывания электронных облаков над и под плоскостью молекулы (рис. 12.6).
Как вы уже знаете (§ 7), в молекулах алканов легко происходит вращение вокруг одинарных связей C — C. Вокруг двойной связи ![]() подобное вращение невозможно, так как оно приведёт к тому, что электронные облака π-связи разомкнутся, π-связь при этом разрушится:
подобное вращение невозможно, так как оно приведёт к тому, что электронные облака π-связи разомкнутся, π-связь при этом разрушится:
Этилен является простейшим представителем алкенов — нециклических углеводородов, молекулы которых содержат одну двойную связь.
Ближайший гомолог этилена — пропилен ![]() . Молекулярная формула пропилена С3Н6. Соседние члены гомологического ряда, как и в случае алканов, различаются по составу на группу СН2. Совершенно очевидно, что следующий гомолог должен иметь состав С4Н8. Отсюда легко можно вывести общую формулу алкенов — СnH2n.
. Молекулярная формула пропилена С3Н6. Соседние члены гомологического ряда, как и в случае алканов, различаются по составу на группу СН2. Совершенно очевидно, что следующий гомолог должен иметь состав С4Н8. Отсюда легко можно вывести общую формулу алкенов — СnH2n.
|
Углеводороды нециклического строения, в молекулах которых имеется одна двойная связь, называются алкенами. Общая формула алкенов CnH2n. Атомы углерода, образующие двойную связь, находятся в состоянии sp2-гибридизации. Ковалентная связь, образованная за счёт перекрывания электронных облаков вдоль линии, соединяющей ядра атомов, называется σ-связь. Ковалентная связь, образованная за счёт бокового перекрывания негибридных p-орбиталей, называется π-связь. Двойная связь включает одну σ- и одну π-связь. π-Связь менее прочная, чем σ-связь. |