§ 14. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам изменения состояния идеального газа
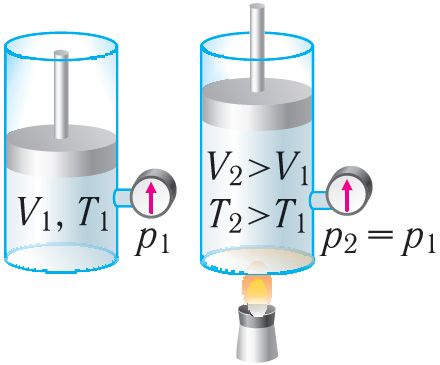
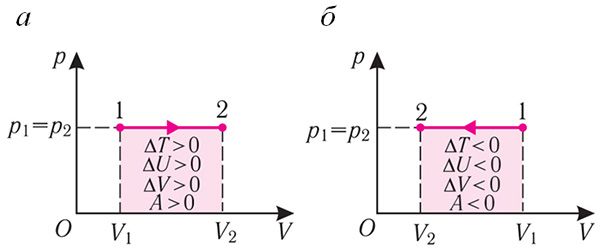
Изобарный процесс. Пусть газ находится в цилиндре, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 80). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики, переданное газу количество теплоты частично расходуется на увеличение внутренней энергии (ΔU > 0) системы и частично идёт на совершение работы силой давления газа при его расширении (А > 0, рис. 80.1, а): Q = ΔU + A.
При изобарном процессе работа расширения (сжатия) газа A = pΔV ≠ 0 и первый закон термодинамики принимает вид
Q = ΔU+ pΔV.
![]()
При изобарном сжатии газа внешние силы совершают работу A' > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q < 0). Понижение температуры газа при изобарном сжатии приводит к уменьшению его внутренней энергии (ΔU < 0). Работа силы давления газа при сжатии А < 0 (рис. 80.1, б).
Сила давления идеального газа при изобарном расширении совершила работу А = 320 Дж. При этом газ получил количество теплоты Q = 680 Дж. Каково приращение внутренней энергии идеального газа?
![]()
Удельная теплоёмкость вещества зависит не только от его свойств, но и от характера осуществляемого процесса теплообмена. Действительно, из формулы Q = cmΔT следует, что удельная теплоёмкость .
Тогда, согласно первому закону термодинамики, при изохорном процессе удельная теплоёмкость идеального газа , а при изобарном —
. Таким образом, для одинакового увеличения температуры при изобарном нагревании единице массы газа необходимо передать большее количество теплоты, чем при изохорном нагревании, т. е. cp > cV. Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов, поэтому для них АΔU и их удельные теплоёмкости слабо зависят от характера осуществляемого процесса (ср ≈ сV).