§ 14. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам изменения состояния идеального газа
Изотермический процесс. Пусть цилиндр с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. И пусть цилиндр изготовлен из вещества с хорошей теплопроводностью. В этом случае внутренняя энергия идеального одноатомного газа, находящегося в цилиндре, остаётся постоянной, и при медленном перемещении поршня её изменение ΔU = 0. Тогда первый закон термодинамики примет вид
Q = A.
![]()
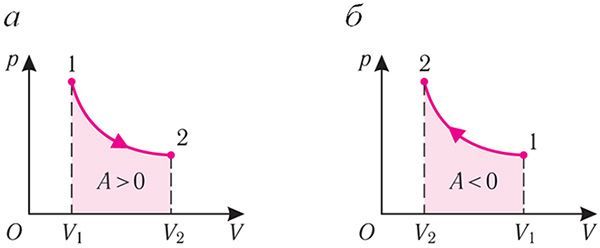
Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался (ΔV > 0, поскольку V2 > V1) (рис. 79), то работа силы давления расширяющегося газа A > 0 (рис. 79.1, а). При одинаковой первоначальной температуре термостата и газа теплопередача не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в цилиндре температура газа успевает выравняться и реально происходящий процесс близок к изотермическому, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде (ΔV < 0, так как V2 < V1), то работа силы давления при сжатии газа A < 0 (рис. 79.1, б) приводит к увеличению внутренней энергии, а следовательно, и его температуры. В результате возникает теплопередача от газа термостату. При сжатии газ отдаёт термостату некоторое количество теплоты Q < 0. Изотермическое сжатие газа происходит за счёт работы внешних сил: A' > 0.
1. Сила давления идеального газа при изотермическом расширении совершила работу А = 3640 Дж. Какое количество теплоты получил газ?
![]()
2. Возможно ли изотермическое сжатие (расширение) определённой массы идеального газа без теплообмена?