§ 2. Будова электронных абалонак атамаў
*Будова электронных абалонак атамаў трэцяга перыяду
Першы элемент трэцяга перыяду — натрый. Яго электронная канфігурацыя:
Na: …3s1
Як бачна, канфігурацыя знешняга электроннага слоя натрыю паўтарае такую для літыю — у атамах абодвух элементаў на знешнім слоі маецца адзін s-электрон, які атам лёгка аддае пры ўтварэнні злучэнняў. Літый і натрый адносяцца да сямейства шчолачных металаў. Так як канфігурацыя знешняга электроннага слоя натрыю і літыю аднолькавая, то хімічныя ўласцівасці гэтых металаў шмат у чым падобныя. Формулы электронных канфігурацый атамаў шчолачных металаў могуць быць выражаны ў агульным выглядзе: ... ns1 (дзе n = 2 для літыю, n = 3 для натрыю і г. д.). На прыкладзе літыю і натрыю відаць, што з павелічэннем зараду ядраў атамаў электронныя канфігурацыі знешняга энергетычнага ўзроўню перыядычна паўтараюцца, таму перыядычна паўтараюцца ўласцівасці хімічных элементаў.
Наступны элемент № 12 — магній. Яго электронная канфігурацыя:
Mg: …3s2
Падобна берылію, магній — метал, які праяўляе ў злучэннях ступень акіслення +2. Але паколькі валентныя электроны магнію знаходзяцца на трэцім энергетычным узроўні і размяшчаюцца далей ад ядра, чым валентныя электроны берылію, металічныя ўласцівасці магнію выяўлены мацней, чым у берылію. Гэта адбіваецца і на характары злучэнняў. Калі аксід і гідраксід берылію праяўляюць амфатэрныя ўласцівасці, MgO з’яўляецца асноўным аксідам, а Mg(OH)2 — асновай.
Элемент № 13 — алюміній. Al: ... 3s23p1. Алюміній таксама, як і бор, праяўляе ў злучэннях ступень акіслення +3, але, у адрозненні ад апошняга, з’яўляецца металам. Аксід алюмінію Al2O3 і гідраксід алюмінію Al(OH)3 амфатэрныя.
Электронная канфігурацыя знешняга слоя элемента № 14 крэмнію паўтарае такую для вугляроду:
Si: ... 3s23p2
Крэмній — неметал. Яго аксід SiO2 з’яўляецца кіслотным аксідам, а гідраксід H2SiO3 — кіслатой.
Элемент № 15 фосфар мае такую ж электронную канфігурацыю знешняга электроннага слоя, як і азот. Але ў адрозненне ад атама азоту, атам фосфару, дзякуючы наяўнасці на знешнім энергетычным узроўні 3d-арбіталей, можа лёгка пераходзіць ва ўзбуджаны стан, у якім маецца пяць няспараных электронаў:
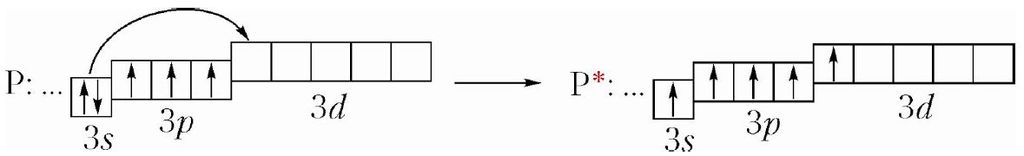
Р: …3s23p3 ![]() P*: …3s13p33d1
P*: …3s13p33d1
Валентнасць фосфару можа быць роўнай III і V. Валентнасць III фосфар праяўляе ў кіслотным аксідзе Р2О3. Валентнасць V — у кіслотным аксідзе Р2О5 і фосфарнай кіслаце Н3РО4.
Элементы, якія могуць праяўляць розныя валентнасці, называюцца полівалентнымі.
Элемент № 16 — сера. Электронная канфігурацыя серы:
S: …3s23p4
Як і атам фосфару, дзякуючы наяўнасці d-арбіталей атам серы можа лёгка пераходзіць ва ўзбуджаныя станы:
S: …3s23p4 ![]() S*: …3s23p33d1
S*: …3s23p33d1 ![]() S**: …3s13p33d2
S**: …3s13p33d2
У асноўным стане ў атама серы маюцца два няспараныя электроны, таму сера можа праяўляць валентнасць II (напрыклад, у серавадародзе H2S). У першым узбуджаным стане ў атама серы маюцца чатыры няспараныя электроны, такім чынам, сера можа праяўляць валентнасць IV (SO2, Н2SO3). Другі ўзбуджаны стан атама серы характарызуецца наяўнасцю шасці няспараных электронаў. Прыклады злучэнняў, у якіх валентнасць серы роўная VI: SO3, серная кіслата H2SO4.
Наступным элементам з’яўляецца хлор. Атамны нумар — 17, электронная канфігурацыя:
Cl: …3s23p5
У асноўным стане ў атама хлору, як і ў яго электроннага аналага фтору, маецца адзін няспараны электрон. Прыклады злучэнняў, у якіх хлор аднавалентны: простае рэчыва Cl2, хлоравадарод HCl. Але дзякуючы наяўнасці d-арбіталей на трэцім энергетычным узроўні атам хлору, як і атамы фосфару і серы, можа лёгка пераходзіць ва ўзбуджаныя станы:
Cl: …3s23p5 ![]() Cl*: …3s23p43d1
Cl*: …3s23p43d1 ![]() Cl**: …3s23p33d2
Cl**: …3s23p33d2 ![]() Cl***: …3s13p33d3
Cl***: …3s13p33d3
Таму хлор можа праяўляць у злучэннях валентнасці I, III, V, VII. Прыклады злучэнняў, дзе валентнасць хлору III, V і VII:

Завяршаецца фарміраванне 3s- і 3p-падузроўняў у элемента № 18 — аргону.
Ar: … 3s23p6
Васьміэлектронная абалонка аргону такая ўстойлівая, што, нягледзячы на наяўнасць 3d-арбіталей, яго атамы не прымаюць удзелу ва ўтварэнні хімічных сувязей, і аргон — інэртны газ.