§ 4. Ковалентная связь
Кратность ковалентной связи
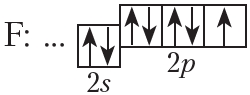
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
От символа F в структурных формулах следует рисовать одну чёрточку: ![]()
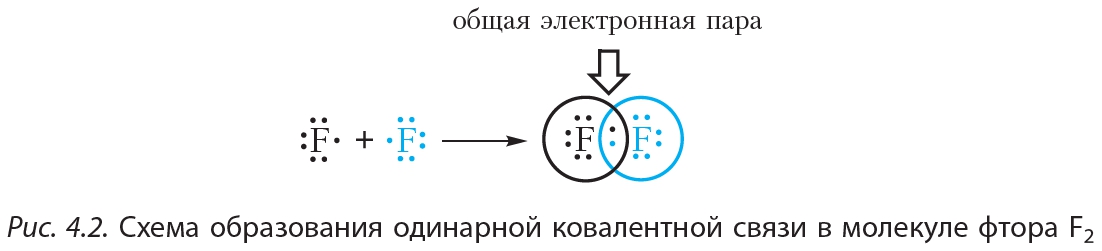
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
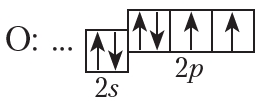
От символа O в структурных формулах следует рисовать две чёрточки: ![]()
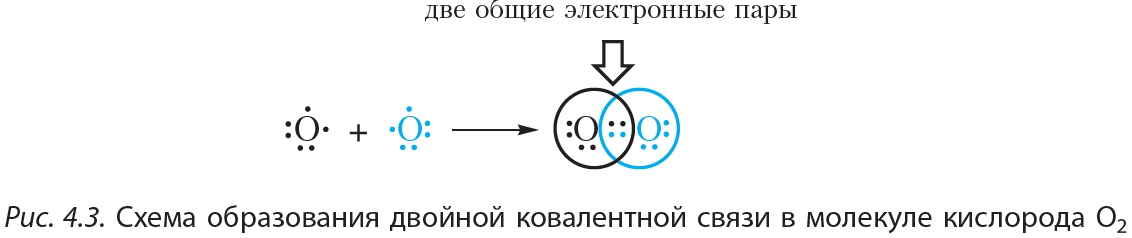
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
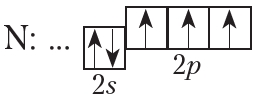
От символа N в структурных формулах следует рисовать три чёрточки:
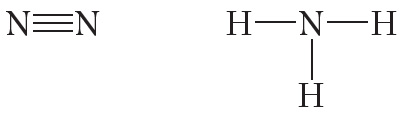
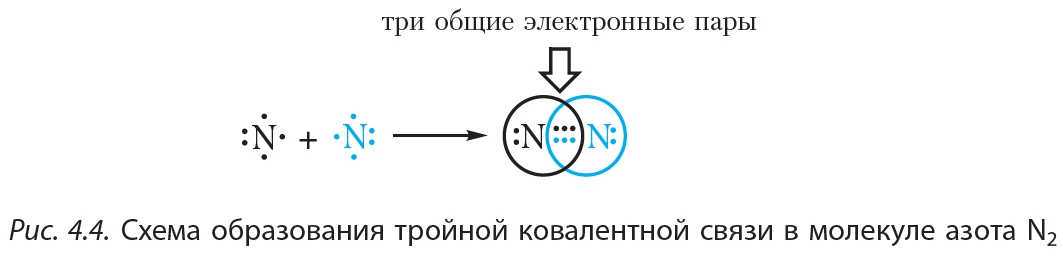
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
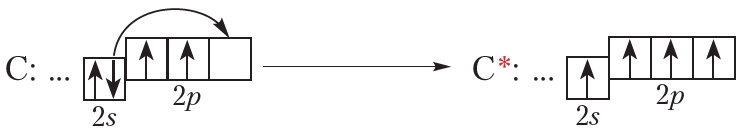
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
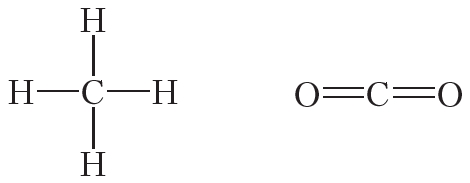
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
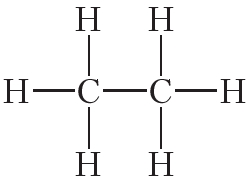
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
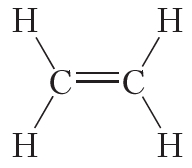 Тройная связь между атомами углерода имеется в молекуле ацетилена (С2Н2):
Тройная связь между атомами углерода имеется в молекуле ацетилена (С2Н2):
![]()