§ 25. Электралітычная дысацыяцыя рэчываў у растворах
*Адрозненне хімічных уласцівасцей іонаў ад уласцівасцей атамаў і малекул
Атамы і малекулы з’яўляюцца электранейтральнымі часціцамі. Катыёны металаў, напрыклад K+, як вам вядома, утвараюцца ў выніку таго, што атамы металаў аддаюць электроны. Аніёны неметалаў, напрыклад Br–, утвараюцца ў выніку далучэння электронаў да атамаў неметалаў.
Уласцівасці катыёнаў і аніёнаў адрозніваюцца ад уласцівасцей адпаведных электранейтральных атамаў. Так, у электрычным полі, якое ствараецца электродамі, адбываецца спарадкаваны рух катыёнаў і аніёнаў электраліту — электрычны ток. Дадатныя іоны — катыёны металаў, H+, і іншых перамяшчаюцца да адмоўнага электрода (катода). Адмоўныя іоны — аніёны кіслотных астаткаў і OH– рухаюцца да дадатнага электрода (анода) (мал. 58.1).
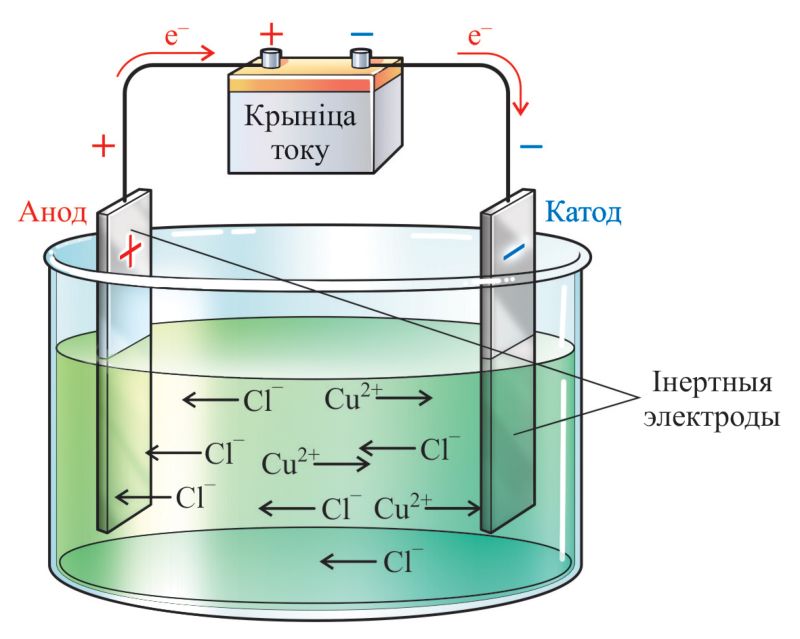
У адрозненне ад нейтральных атамаў (у прыватнасці, атамаў металаў) катыёны, напрыклад Cu2+, Fe3+ і іншыя, маюць меншы лік электронаў на знешніх электронных узроўнях і меншы памер, заўсёды могуць выступаць у якасці акісляльніку і прымаць электроны:
CuSO4 + Zn = ZnSO4 + Cu↓
або Cu2+ + Zn = Zn2+ + Cu↓.
У параўнанні з нейтральнымі атамамі (I, S, O) простыя аніёны, напрыклад I–, S2– , O2– і іншыя, маюць большую колькасць электронаў на знешніх электронных узроўнях і большы памер, могуць выступаць у якасці адноўніку і аддаваць электроны:
2NaI + Cl2 = 2NaCl + I2
або 2I– + Cl2 = 2Cl– + I2.