§ 7. Будова атама
Адно з найбольш ранніх сцвярджэнняў пра атамы як непадзельныя часціцы рэчыва ўтрымліваецца ў працах старажытнагрэчаскага вучонага Дэмакрыта (V–IV стст. да н. э.). Толькі ў канцы XIX стагоддзя дзякуючы шэрагу навуковых адкрыццяў у галіне фізікі стала зразумела, што атам мае складаную будову.
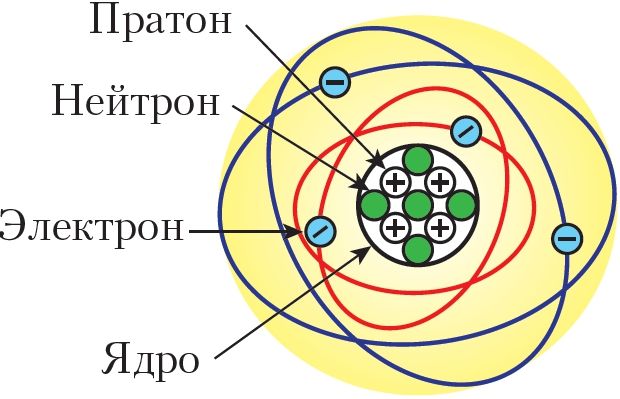
У 1911 годзе Э. Рэзерфорд на аснове эксперыментальных даных прапанаваў ядзерную (планетарную) мадэль будовы атама. У гэтай мадэлі атам разглядаўся як своеасаблівая «сонечная сістэма», у цэнтры якой знаходзіцца дадатна зараджанае ядро, а вакол ядра па сваіх арбітах рухаюцца электроны.
Далейшыя даследаванні фізікаў паказалі, што ядры атамаў складаюцца з пратонаў і нейтронаў. Нейтрон не мае зараду, а пратон нясе дадатны зарад, роўны велічыні зараду электрона. Лік пратонаў у ядры вызначае яго зарад па абсалютнай велічыні і парадкавы нумар элемента (мал. 11).
Доказамі складанай будовы атама паслужылі адкрыцці фотаэфекту (А. Г. Сталетаў, 1889), радыеактыўнасці (А. Бекерэль, М. Складоўская-Кюры, 1896–1899 гг.), катодных прамянёў (Дж. Томсан, 1897), эксперыменты па вызначэнні прыроды α-часціц (Э. Рэзерфорд, 1899– 1900).
Даследаванні прыроды часціц, якія ўваходзяць у састаў атамаў, былі дапоўнены ўяўленнямі квантавай механікі, якія развівалі М. Планк, А. Эйнштэйн, Н. Бор, Луі дэ Бройль, У. Гейзенберг, Э. Шродынгер.
Калі зарад электрона, роўны 1,6 ∙ 10–19 Кл, прыняць за 1, то зарад ядра любога атама будзе колькасна роўны парадкаваму нумару Z адпаведнага хімічнага элемента або ліку пратонаў у ядры. У такім выпадку зарад ядра выражаны ў адзінках элементарнага зараду. Гэта безразмерная велічыня, як і адносная атамная маса. Напрыклад, уран — хімічны элемент з парадкавым нумарам 92. Зарад яго ядра ў адносных адзінках роўны 92.
Сумарны лік пратонаў (Z) і нейтронаў (N) у ядры называецца масавым лікам (А):
A = Z + N.
Масавы лік А мае толькі цэлалікавыя значэнні.
Атам у свабодным стане з’яўляецца электранейтральнай часціцай. Такім чынам, лік пратонаў у ядры атама роўны ліку электронаў. Найважнейшыя характарыстыкі пратонаў, нейтронаў і электронаў прыведзены ў табліцы 4.
Табліца 4. Найважнейшыя характарыстыкі пратонаў, нейтронаў, электронаў
| Характарыстыкі | Ядро | Абалонка | |
| Пратон | Нейтрон | Электрон | |
| Сімвал | p | n | e— |
| Маса, кг | ≈ 1,673 ∙ 10–27 | ≈ 1,675 ∙ 10–27 | ≈ 9,109 ∙ 10–31 |
| Маса, а. а. м. | 1,0073 ≈ 1 | 1,0087 ≈ 1 | 0,0005 ≈ 0 |
| Электрычны зарад, Кл | ≈ 1,602 ∙ 10–19 | 0 | ≈ –1,602 ∙ 10–19 |
| Электрычны зарад у адзінках элементарнага зараду | +1 | 0 | –1 |
| Абазначэнне ва ўраўненнях ядзерных рэакцый | |||
Масу ядра (mz) можна прыблізна вызначыць, падсумаваўшы масы ўсіх пратонаў (Zmp) і нейтронаў (Nmn), з якіх яно складаецца.
Дакладнае значэнне масы ядра крыху меншае за гэтую суму:
mz < Zmp + Nmn.
Напрыклад, маса ядра нукліду кісларод-16 роўная 15,995. Розніца тлумачыцца вылучэннем каласальнай энергіі пры ўтварэнні ядра з пратонаў і нейтронаў. Менавіта з-за вылучэння гэтай энергіі, якая называецца энергіяй сувязі (ΔE), адбываецца страта агульнай масы. Энергія сувязі ў ядры ў мільёны разоў перавышае трываласць хімічнай сувязі, таму ядры атамаў у хімічных рэакцыях не разбураюцца.
У курсе фізікі 11-га класа вы навучыцеся разлічваць «дэфект мас» і энергію сувязі, зыходзячы з роўнасці , дзе с — скорасць святла ў вакууме.
Пры ўтварэнні з пратонаў і нейтронаў 1 моль атамаў гелію, у ядрах якіх утрымліваецца па два пратоны і па два нейтроны, вылучаецца 2,73 · 1012 Дж энергіі. Для параўнання: пры ўтварэнні вельмі трывалай трайной хімічнай сувязі ў малекуле азоту вылучаецца энергія 9,45 · 105 Дж/моль, гэта значыць амаль у 3 мільёны разоў меншая.
Лік нейтронаў у ядрах атамаў аднаго і таго ж хімічнага элемента можа вар’іравацца ў невялікіх межах.
Доўгі час лічылі, што хімічны элемент — гэта выгляд атамаў з пэўнай масай. Аднак у 1913 годзе было ўстаноўлена, што ў аднаго і таго ж хімічнага элемента могуць быць атамы, якія адрозніваюцца па масе. Такія разнавіднасці атамаў назвалі ізатопамі.
Ізатопы — гэта атамы, якія адносяцца да аднаго хімічнага элемента, але адрозніваюцца па масе. Іх ядры складаюцца з аднолькавага ліку пратонаў, але рознага ліку нейтронаў.
Акрамя паняцця ізатопаў існуе паняцце нукліды.
Разнавіднасць атамаў з вызначанай колькасцю пратонаў і нейтронаў у ядры называюць нуклідам (ад лац. nucleus — ядро). Сукупнасць атамаў, у ядрах якіх утрымліваецца аднолькавы лік пратонаў, адносяць да аднаго хімічнага элемента, гэта значыць усе атамы аднаго хімічнага элемента маюць аднолькавы зарад ядра.
Нукліды прынята абазначаць , дзе Э — сімвал хімічнага элемента, Z — лік пратонаў у ядры (атамны нумар элемента), A — масавы лік, роўны сумарнаму ліку пратонаў і нейтронаў у ядры. Напрыклад:
,
,
.
Большасць хімічных элементаў у прыродзе існуе ў выглядзе некалькіх нуклідаў. Так, крэмній мае тры стабільныя нукліды, а волава — дзесяць.
У цяперашні час для 118 элементаў вядома больш як 3400 нуклідаў.
Напрыклад, нукліды ,
и
, якія існуюць у прыродзе, — ізатопы вадароду, бо належаць да аднаго і таго ж хімічнага элемента, але адрозніваюцца лікам нейтронаў у ядры атама (мал. 12). Іх называюць вадарод-1, або процій (H), вадарод-2, або дэйтэрый (D), вадарод-3, або трыцій (T). Масы атамаў вадароду-1, вадароду-2 і вадароду-3 роўныя 1,008, 2,014 і 3,016 а. а. м., ці прыблізна 1, 2 і 3 а. а. м.
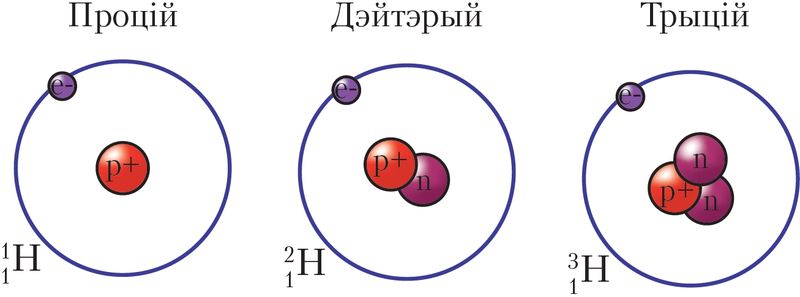
Рэчывы, якія змяшчаюць розныя ізатопы, практычна не адрозніваюцца хімічнымі ўласцівасцямі, але маюць адрозненні ў некаторых фізічных уласцівасцях. Напрыклад, вада H2O, у састаў малекул якой уваходзіць процій, замярзае пры 0 °С. У той жа час вада, якая складаецца з малекул D2O, замярзае пры 3,81 °С, а з малекул T2O — пры 4,48 °С.
Значэнне атамных мас ізатопаў і іх адноснае ўтрыманне вызначаюць метадам мас-спектраскапіі. Менавіта з улікам значэнняў атамных мас ізатопаў і іх долі ў прыродзе вылічваюць адносную атамную масу хімічных элементаў.
Удакладнім азначэнне, прыведзенае раней на с. 7. Адносная атамная маса хімічнага элемента — фізічная велічыня, роўная адносінам усярэдненай масы атамаў элемента да часткі масы атама вугляроду-12 (12С). Цяпер становіцца зразумелым, што маецца на ўвазе пад тэрмінам «усярэдненая маса» атамаў элемента. Яе можна разлічыць, маючы звесткі аб дакладным значэнні масы і распаўсюджанасці ізатопаў элемента. Пакажам гэты разлік на наступным прыкладзе.
Прыклад 1. Вядома, што хімічны элемент кісларод у прыродзе прадстаўлены трыма ізатопамі: ,
и
. Іх адносныя атамныя масы адпаведна роўныя 15,995, 16,999 і 17,999. У ізатопнай сумесі на долю атамаў кіслароду-16 прыходзіцца 99,757 %, кіслароду-17 — 0,038 %, а кіслароду-18 — 0,205 %. Разлічыце адносную атамную масу элемента кіслароду.
Рашэнне. Для нагляднасці разліку вылучым 100 000 атамаў гэтай ізатопнай сумесі. Тады ў ёй будзе 99 757 атамаў кіслароду-16, усяго толькі 38 атамаў кіслароду-17 і 205 атамаў кіслароду-18. Для вызначэння сярэдняга значэння адноснай атамнай масы кіслароду, відавочна, трэба скласці масы ўсіх атамаў і падзяліць на лік гэтых атамаў:
Атрыманае значэнне супадае з тым, што прыведзена ў перыядычнай сістэме.
Адносная атамная маса хімічнага элемента — гэта ўсярэдненае значэнне адносных атамных мас яго ізатопаў з улікам іх распаўсюджанасці.
Варта памятаць, што кожнаму нукліду ўласцівы пэўны масавы лік. Нельга гаварыць пра масавы лік хімічнага элемента, бо ў прыродзе ў аднаго і таго ж хімічнага элемента можа быць некалькі ізатопаў.
Невялікія адрозненні фізічных уласцівасцей рэчываў, якія ўключаюць розныя ізатопы аднаго і таго ж элемента, прыводзяць да таго, што ізатопны састаў рэчыва залежыць ад спосабу яго атрымання і існавання. Напрыклад, цукроза бураковага цукру змяшчае менш нуклідаў 13C, чым цукроза, выдзеленая з цукровага трыснягу. Такія адрозненні нярэдка дазваляюць вызначыць паходжанне рэчыва. Звесткі пра ізатопны састаў рэчываў выкарыстоўваюцца ў геалогіі, медыцынскай дыягностыцы, крыміналістыцы, для кантролю стану навакольнага асяроддзя.
У прыродзе 21 хімічны элемент існуе ў выглядзе толькі аднаго стабільнага нукліду. Да іх адносяцца Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi, Pa. Іх адносныя атамныя масы ў перыядычнай сістэме ўказаны са значна большай дакладнасцю, чым для элементаў, якія існуюць у выглядзе сумесі ізатопаў.