§ 38. Азотная кислота
Химические свойства
HNO3 — сильная одноосновная кислота, проявляет общие свойства кислот, обусловленные ионом водорода, а окислительные свойства — за счёт атома азота в достаточно высокой степени окисления +5.
I. Общие химические свойства. К общим химическим свойствам азотной кислоты относятся её действие на индикаторы и образование солей. Изменение окраски индикаторов происходит за счёт ионов водорода Н+, образующихся при диссоциации кислоты:
.
Соли (нитраты) образуются при взаимодействии с основными и амфотерными оксидами (1), гидроксидами металлов (2), другими солями (3):
II. Окислительные свойства азотной кислоты. Эти свойства HNO3 проявляет в реакциях с металлами, неметаллами, органическими веществами.
Она окисляет металлы, расположенные в ряду активности как до водорода, так и после водорода, кроме золота и платины. Так, при взаимодействии концентрированной азотной кислоты с медью и другими малоактивными металлами (Ag, Hg и др.) продуктом восстановления является оксид азота(IV) — бурый газ:
,
а в разбавленной азотной кислоте — оксид азота(II):
.
Состав образующихся продуктов зависит как от концентрации азотной кислоты, так и от активности металла. При этом чем ниже концентрация азотной кислоты и выше активность металла, тем сильнее восстанавливается азот.
С более активными металлами продуктами восстановления могут быть N2O, NO, NO2, N2, NH4NO3. В общем виде взаимодействие азотной кислоты с металлами можно представить схемой:
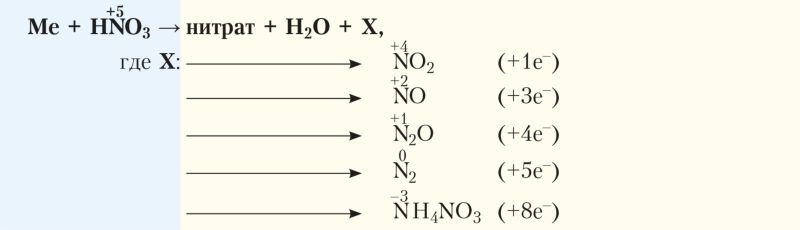
Как правило, в реакции образуется смесь продуктов восстановления с преобладанием отдельных из них.
Вспомним также (9 кл.), что концентрированная азотная кислота при низких температурах не взаимодействует с железом, хромом, алюминием, кобальтом — пассивирует их. Помимо металлов, азотная кислота окисляет многие неметаллы (C, S, P). Органические вещества в концентрированной кислоте могут воспламеняться (амины, скипидар).