§ 3.1. Оксиды
Оксиды получают окислением кислородом простых и сложных веществ, (как неорганических, так и органических), а также термическим разложением гидроксидов (кислот, оснований, амфотерных гидроксидов), кислородсодержащих солей (табл. 1.2).
Таблица 1.2. Способы получения оксидов
| Способы получения оксидов | ||
|---|---|---|
| Взаимодействие простых и сложных веществ с кислородом | Разложение сложных веществ — оснований, солей, кислот | Другие способы |
Некоторые металлы (Мg, Zn), а также углерод образуют оксиды в реакциях с парами воды. Дополнительно отметим лабораторный способ получения оксида углерода(IV) реакцией обмена, в которой используют мрамор и соляную кислоту:
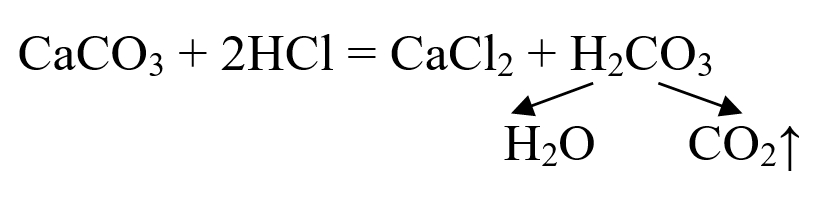
Получаемый оксид СО2 можно рассматривать как продукт разложения угольной кислоты.
Следует также помнить, что при окислении кислородом азотсодержащих веществ (аммиака NH3, аминов RNH2 и др.) азот выделяется в виде простого вещества N2, а оксид азота(II) образуется в присутствии катализатора.