§ 35. Пратонна-нейтронная мадэль будовы ядра атама
|
Вы ўжо ведаеце, што рэчывы складаюцца з драбнюткіх часціц — атамаў, якія ўзаемадзейнічаюць паміж сабой. Вывучаючы будову і ўласцівасці атама, можна ствараць новыя крыніцы энергіі, рэчывы з загадзя зададзенымі ўласцівасцямі, выкарыстоўваць новыя магчымасці ў медыцыне, тэхналогіі вытворчасці. У гэтай сувязі неабходна адказаць на пытанні: якую будову мае атам? Якім заканамернасцям ён падпарадкоўваецца? |
У фізіцы за атамную адзінку масы (1 а. а. м.) прымаецца велічыня, роўная масы ізатопа вугляроду
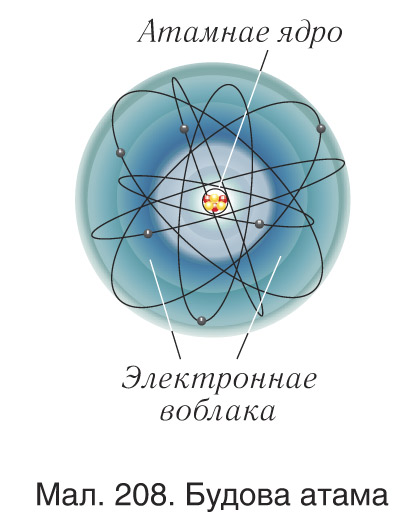
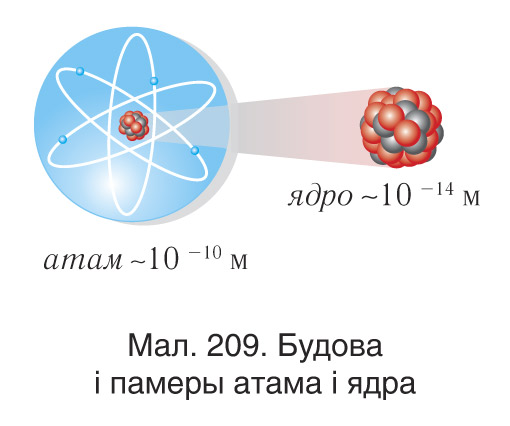
У эксперыментах Рэзерфарда па вывучэнні рассейвання α-часціц рэчывам было вызначана, што ў цэнтральнай частцы атама,памеры якога знаходзіцца дадатна зараджанае ядро, якое мае памер
, у якім засяроджана 99,96 % ад масы атама (мал. 208). Для завяршэння пабудовы мадэлі атама неабходна было адказаць на пытанне: ці мае атамнае ядро структуру, і калі мае, то якую? Наяўнасць у ядры дадатна зараджаных часціц — пратонаў — была эксперыментальна даказана Рэзерфардам з яго вучнямі ў 1919 г. Пратон, які абазначаецца лацінскай літарай p, уяўляе сабой ядро атама вадароду. Ён мае масу
і зарад, роўны па абсалютнай велічыні зараду электрона
.
У 1930 г. нямецкія вучоныя Вальтэр Батэ і Ганс Бекер, вывучаючы рэакцыі, якія адбываюцца пры апраменьванні берылію α-часціцамі, выявілі новае выпраменьванне, што валодае вельмі вялікай пранікальнай здольнасцю, першапачаткова названае берыліевымі праменямі. У 1932 г. англійскі фізік Джэймс Чэдвік правёў эксперыменты па вывучэнні ўласцівасцей гэтага выпраменьвання і ўстанавіў, што берыліевыя прамені складаюцца з электрычна нейтральных часціц з масай, параўнальнай з масай пратона. Гэтыя часціцы ён назваў нейтронамі (ад англ. neutral — нейтральны).

Нейтрон — яшчэ адна часціца нароўні з электронам, пратонам і фатонам. Гэта часціца абазначаецца лацінскай літарай n. Яна мае масу , якая амаль супадае з масай пратона, і электрычна нейтральная. З-за адсутнасці электрычнага зараду ў нейтрона ўзаемадзеянне з рэчывам вельмі слабае. З прычыны гэтага нейтрон рухаецца ў рэчыве прамалінейна да таго часу, пакуль не сутыкнецца з якім-небудзь атамным ядром. Пры сутыкненнях з цяжкімі атамамі нейтрон амаль не губляе энергію, як пругкі мячык, які адскоквае ад сцяны. Пры сутыкненні ж з лёгкімі атамамі (вадарод, берылій, вуглярод) нейтрон перадае ім частку сваёй энергіі і пачынае рухацца павольней. Рэчывы, якія змяшчаюць лёгкія атамы, называюць запавольнікамі нейтронаў. Найбольш эфектыўнымі запавольнікамі нейтронаў з’яўляюцца рэчывы, якія змяшчаюць вадарод (напрыклад, вада), з прычыны таго, што маса атама вадароду блізкая да масы нейтрона. З часам кінетычная энергія нейтрона становіцца такой жа, як кінетычная энергія цеплавога руху часціц навакольнага асяроддзя. Такія нейтроны, што адносна павольна рухаюцца, называюцца цеплавымі.
Нейтроны ўстойлівыя толькі ў складзе стабільных ядзер. Нейтрон у свабодным стане, г. зн. змешчаны па-за ядром, з’яўляецца нестабільнай часціцай. Яго сярэдні час жыцця t = 886 c.
Пасля адкрыцця нейтронаў у 1932 г. фізікі — савецкі Дзмітрый Дзмітрыевіч Іваненка і нямецкі Вернер Гейзенберг — прапанавалі пратонна-нейтронную мадэль будовы ядра. Паводле гэтай мадэлі ядро складаецца з часціц двух тыпаў — пратонаў і нейтронаў (мал. 209).

У адпаведнасці з сучаснымі фізічнымі ўяўленнямі пратон і нейтрон з’яўляюцца двума рознымі зарадавымі станамі адной і той жа часціцы — нуклона (ад лац. nucleus — ядро). У стане без электрычнага зараду (q = 0) нуклон з’яўляецца нейтронам, а ў стане з дадатным электрычным зарадам (q = e) — пратонам.
Лік пратонаў у ядры называецца зарадавым лікам (атамным нумарам) і абазначаецца літарай Z. (Лік пратонаў у ядры роўны колькасці электронаў у нейтральным атаме.) Зарадавы лік супадае з парадкавым нумарам хімічнага элемента ў перыядычнай сістэме элементаў Мендзялеева. Агульны лік нуклонаў называецца масавым лікам і абазначаецца літарай A. Масавы лік супадае з акругленай да цэлага ліку атамнай масай элемента. Пратон і нейтрон маюць масавы лік A = 1, а электрон A = 0. Лік нейтронаў у ядры роўны N = A – Z.
Для характарыстыкі ядра дастаткова ведаць зарадавы Z і масавы A лікі. Для абазначэння атамнага ядра выкарыстоўваецца такі ж сімвал, як для адпаведнага хімічнага элемента. Злева ўнізе сімвала ставіцца зарадавы лік ядра Z, а ўверсе — масавы лік A. Напрыклад, сімвал
абазначае ядро вугляроду, якое змяшчае 12 нуклонаў, 6 з якіх пратоны, а 6 іншых — нейтроны.
Атам з пэўнымі значэннямі зарадавага ліку Z і масавага ліку A называецца нуклідам.
У ядрах аднаго хімічнага элемента заўсёды ўтрымліваецца адна і тая ж колькасць пратонаў, а лік нейтронаў можа быць розным. Напрыклад, у ядрах вугляроду лік пратонаў заўсёды 6, а лік нейтронаў можа быць 5, 6, 7, 8, 9 ці 10.
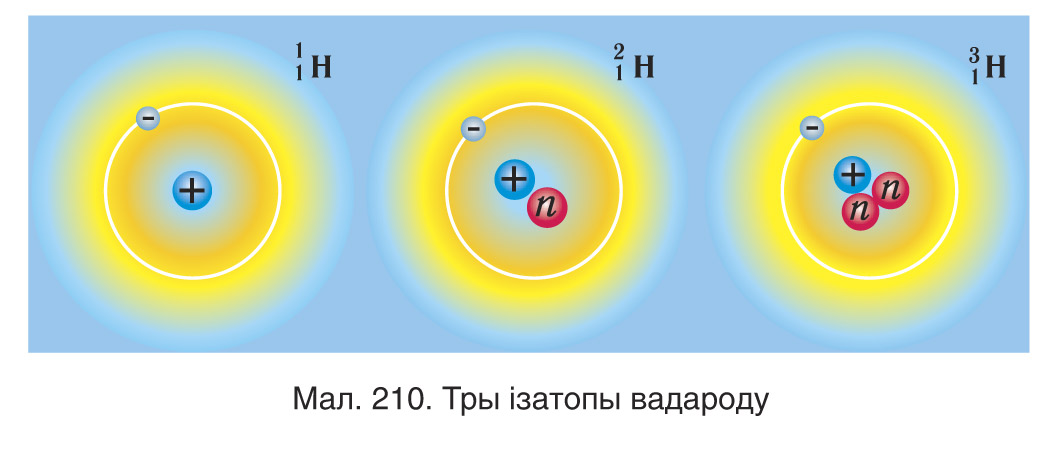
Атамы, ядры якіх утрымліваюць аднолькавы лік пратонаў, але розны лік нейтронаў, называюцца ізатопамі (ад грэч. (ізас) — аднолькавы і τοπος (топас) — месца) дадзенага хімічнага элемента. Напрыклад, добра вядомы ізатопы вадароду — дэйтэрый
і трытый
, якія змяшчаюць, адпаведна, адзін і два нейтроны ў ядры (мал. 210).
У 1962 г. фізікі і хімікі прынялі за масавы лік вугляроду велічыню, роўную дакладна 12,00000 і разлічылі атамныя масы ўсіх астатніх элементаў адносна
. Хоць масавы лік ізатопа звычайна прыводзіцца цэлым лікам, на самай справе ён «не зусім» цэлы. Так, напрыклад, масавыя лікі кіслароду
, калію
і урану
роўны адпаведна 18, 41, 235. Метадамі мас-спектраскапіі атрымалася з вельмі вялікай дакладнасцю вымераць масы асобных ізатопаў. У адносіне да вугляроду
маса кіслароду
роўна
, калію
—
, урану
—
Маса пратона
, нейтрона —
Масы некаторых атамаў прыведзены ў табліцы 10.
Табліца 10. Масы атамаў хімічных элементаў
| Элемент |
Ізатоп |
Маса атама, а. а. м. |
Элемент | Ізатоп |
Маса атама, а. а. м. |
| Вадарод | 1,00783 |
Вуглярод |
11,01143 | ||
| Вадарод | 2,01410 |
Вуглярод |
12,00000 | ||
| Вадарод | 3,01605 | Азот | 14,00307 | ||
|
Гелій |
4,00260 |
Кісларод |
15,99491 | ||
|
Літый |
6,01513 | Фтор | 18,99840 | ||
|
Літый |
7,01601 |
Алюміній |
26,98146 | ||
|
Берылій |
8,00531 |
Крэмній |
27,98154 | ||
| Берилий | 9,01218 | Уран | 235,04393 | ||
| Бор | 10,01296 | Уран | 238,05079 | ||
| Бор | 11,00931 |
Плутоній |
239,05216 |
Хімічныя ўласцівасці элементаў вызначаюцца не атамнай масай, а зарадавым лікам ядра, г. зн. лікам электронаў у электрычна нейтральным атаме элемента і іх размеркаваннем па энергетычных узроўнях. Сапраўды, атамныя масы ізатопаў адрозніваюцца, а іх хімічныя ўласцівасці аднолькавыя. Напрыклад, атамы нуклідаў вадароду і гелію
маюць блізкія па велічыні атамныя масы, але прынцыпова розныя хімічныя ўласцівасці.
У рамках пратонна-нейтроннай мадэлі ядра паўстае пытанне аб яго ўстойлівасці. Сапраўды, паміж змешчанымі ў ядры пратонамі дзейнічаюць сілы электрастатычнага адштурхвання велізарнай велічыні. Калі лічыць адлегласць паміж пратонамі то модуль сілы адштурхвання
, а гравітацыйная сіла іх прыцягнення складае ўсяго
.
Чым жа тлумачыцца ўстойлівасць ядра, калі ўнутры яго дзейнічаюць такія велізарныя сілы кулонаўскага адштурхвання паміж пратонамі?
Прычына ўстойлівасці ядра заключаецца ў існаванні, акрамя сіл электрастатычнага адштурхвання паміж пратонамі (нуклонамі), ядзерных сіл прыцягнення паміж нуклонамі. Ядзерныя сілы адрозніваюцца па сваёй прыродзе як ад сіл электрамагнітных, так і ад сіл гравітацыйных. Яны ўяўляюць сабой новы від узаемадзеяння паміж нуклонамі, які называюць моцным узаемадзеяннем.
Ядзерныя сілы маюць шэраг адметных уласцівасцей:
1) з’яўляюцца сіламі прыцягнення і адштурхвання;
2) на адлегласцях парадку памеру ядра прыкладна ў 100 разоў пераўзыходзяць па велічыні кулонаўскія сілы адштурхвання ў ядры;
3) праяўляюцца толькі на адлегласцях паміж часціцамі парадку памеру ядра г. зн. з’яўляюцца караткадзеючымі сіламі. На адлегласцях, большых за
, яны не праяўляюцца;
4) не залежаць ад электрычнага зараду нуклонаў, якія ўзаемадзейнічаюць (ядзерныя сілы паміж двума пратонамі, нейтронамі ці пратонам і нейтронам аднолькавыя). Гэта ўласцівасць называецца зарадавай незалежнасцю;
5) маюць уласцівасць насычэння. Гэта азначае, што змешчаныя ўнутры ядра нуклоны могуць узаемадзейнічаць толькі са сваімі бліжэйшымі суседзямі;
6) не з’яўляюцца цэнтральнымі, г. зн. яны не накіраваны па лініі, якая злучае цэнтры нуклонаў, што ўзаемадзейнічаюць.
Эксперыменты паказалі, што многія ядры маюць прыкладна сферычную форму, а аб'ём ядра прапарцыянальны масаваму ліку А. Згодна з эксперыментальнымі данымі радыус ядзер нарастае ў залежнасці ад масавага ліку ў адпаведнасці з формулай:
Паколькі аб’ём шара , то аб’ём ядра прапарцыянальны масаваму ліку А.
Усе ядры маюць шчыльнасць а адзін кубічны сантыметр ядзернага рэчыва мае масу 180 млн тон.
Калі б можна было вырабіць запалкавую галоўку з ядзернага рэчыва аб'ёмам некалькі кубічных міліметраў, то яна мела б масу каля мільёна тон. Гэта адпавядае масе вады ў кубічным рэзервуары са стараной 100 м.
Паколькі масы і энергіі ядзерных велічынь у адзінках СІ маюць вельмі малыя значэнні, для зручнасці вылічэнняў усе масы ў ядзернай фізіцы выражаюць у атамных адзінках масы (а. а. м.), а энергіі — у электронвольтах (эВ). Выкарыстаўшы формулу Эйнштэйна E = mc2, масу таксама можна выразіць у адзінках энергіі — электронвольтах: Напрыклад, у атамных адзінках масы маса электрона me = 0,00054858 а. а. м., маса пратона mp = 1,007276 а. а. м., маса нейтрона mn = 1,008665 а. а. м., маса атама вадароду mp = 1,007825 а. а. м., а ў энергетычных адзінках me = 0,511 МэВ, mp = 938,281 МэВ, mn = 939,567 МэВ
Сувязь паміж рознымі адзінкамі масы вызначаецца наступнымі суадносінамі:
|
|
|
Ізатопы выкарыстоўваюцца ў біялогіі для вывучэння працэсу фотасінтэзу, для даследавання выкарыстання раслінамі фосфару, азоту, калію і мікраэлементаў, пры даследаванні працэсаў абмену рэчываў і біясінтэзу; у медыцыне — пры дыягностыцы захворванняў, для радыеімуннага аналізу і тамаграфіі; у экалогіі — для даследавання пераносу, назапашвання і распаду розных забруджвальнікаў у паветры, вадзе і глебе. Д. Чэдвік за адкрыццё нейтрона атрымаў Нобелеўскую прэмію па фізіцы ў 1935 г. |
 |