§ 42-1. Трансгенные животные. Генодиагностика и генотерапия. Клеточная инженерия
*Вы уже знаете, что в клетки бактерий, грибов и растений можно ввести и заставить функционировать гены различных организмов. Разработаны также и методы создания генно-инженерных конструкций, пригодных для введения генетической информации в клетки животных и человека.
Для этих целей используются бактериальные плазмиды, в которые первоначально с помощью рестриктаз и лигаз встраивают гены, предназначенные для введения в клетки животных. Затем такие плазмиды вводят в клетки бактерий, чаще всего лабораторных штаммов кишечной палочки (см. рис. 41.1). Полученный таким образом штамм используют для наработки нужного количества ДНК, содержащей необходимый ген. Такая процедура называется клонированием гена и обычно используется не только для получения трансгенных животных, но и для получения любых других генетически модифицированных организмов.
На следующем этапе клонированный ген переносят из бактериальных плазмид в особые молекулы ДНК, которые могут обеспечить поддержание и реализацию генетической информации в клетках животных. Чаще всего для таких целей используются нуклеиновые кислоты определенных вирусов животных или человека. Затем полученные таким образом молекулы вводят в клетки животных.*
Получение и применение трансгенных животных. Генетическая инженерия животных — наиболее сложное из всех биотехнологических направлений. Это связано с отсутствием у всех позвоночных животных бесполого размножения, а у млекопитающих — еще и с невозможностью развития потомства вне материнского организма. Однако биотехнология XXI в. сумела преодолеть эти трудности.
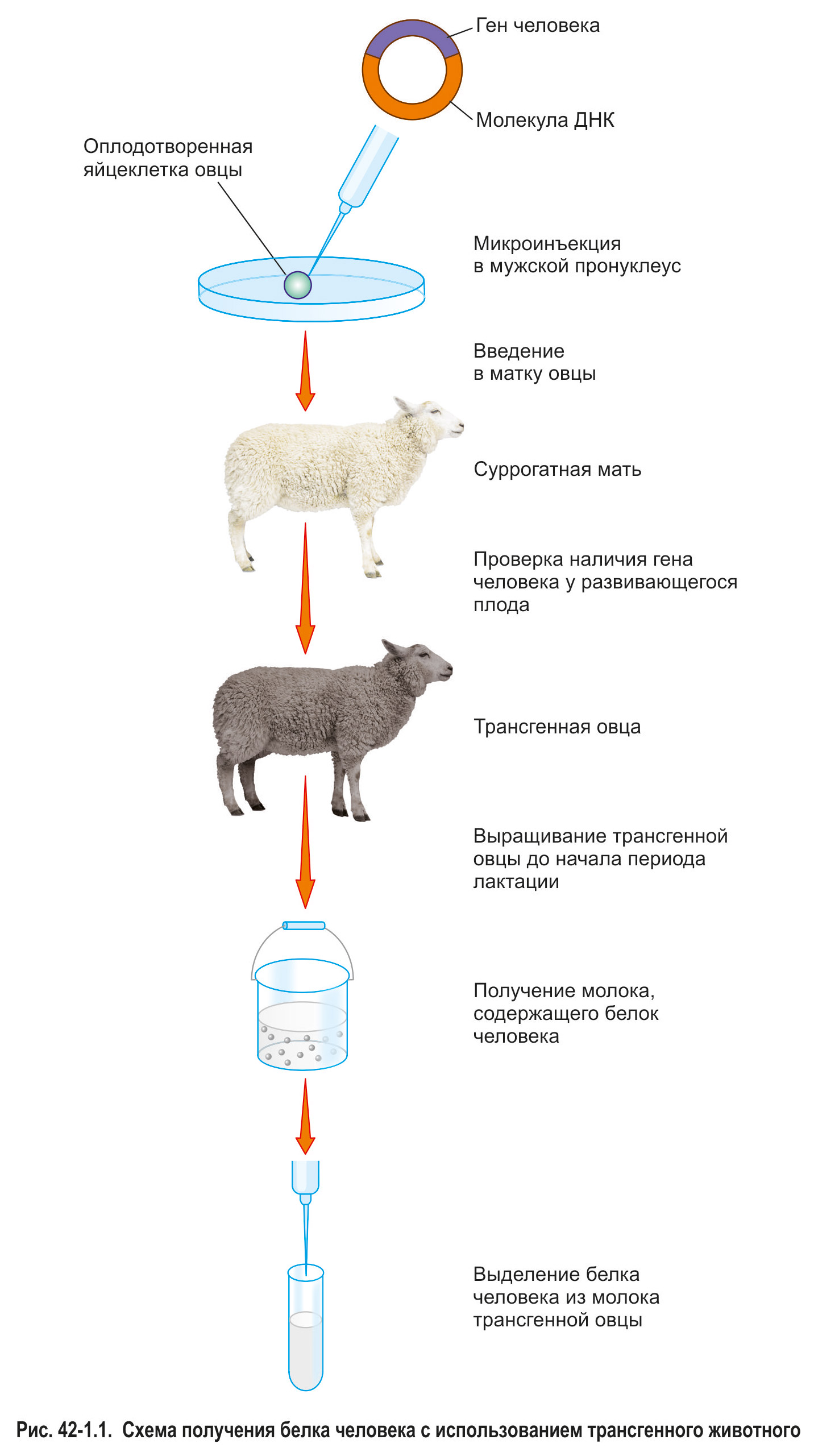
В настоящее время разработаны методы введения дополнительной генетической информации в клетки практически любых организмов. Но получить трансгенное млекопитающее удается только с использованием сложных методологических подходов. Наиболее успешным является метод микроинъекций в мужской пронуклеус.
Для осуществления микроинъекций используют клетки, полученные сразу после слияния яйцеклетки и сперматозоида. У млекопитающих после слияния половых клеток в течение нескольких часов ядра сперматозоида и яйцеклетки (мужской и женский пронуклеусы соответственно) остаются не слившимися. В мужской пронуклеус с помощью специального прибора вводят молекулы ДНК, содержащие нужные гены. Через некоторое время происходит слияние пронуклеусов, и зигота начинает делиться. Такие зиготы вводятся в матку специально подготовленной самки (суррогатной матери). Через положенный для вынашивания плода срок рождается трансгенный детеныш. Таким способом можно получить трансгенное животное практически любого вида млекопитающих.
Трансгенных животных получают для научных и практических целей. В частности, на лабораторных трансгенных мышах созданы модели целого ряда наследственных заболеваний человека. На таких животных отрабатываются возможные пути предотвращения этих заболеваний и оказания медицинской помощи болеющим.
Некоторые белки человека не удается нарабатывать с использованием бактерий, грибов или культур клеток животных. В этом случае методом микроинъекций можно получить животное, в молоке которого будет содержаться белок медицинского назначения (рис. 42-1.1). Примером может служить один из факторов свертывания крови человека, который необходимо периодически вводить больным гемофилией. По расчетам ученых, стадо трансгенных животных (например, овец) с численностью около сотни особей будет способно обеспечить необходимым белком всех гемофиликов мира. Таких животных называют животными-биореакторами.
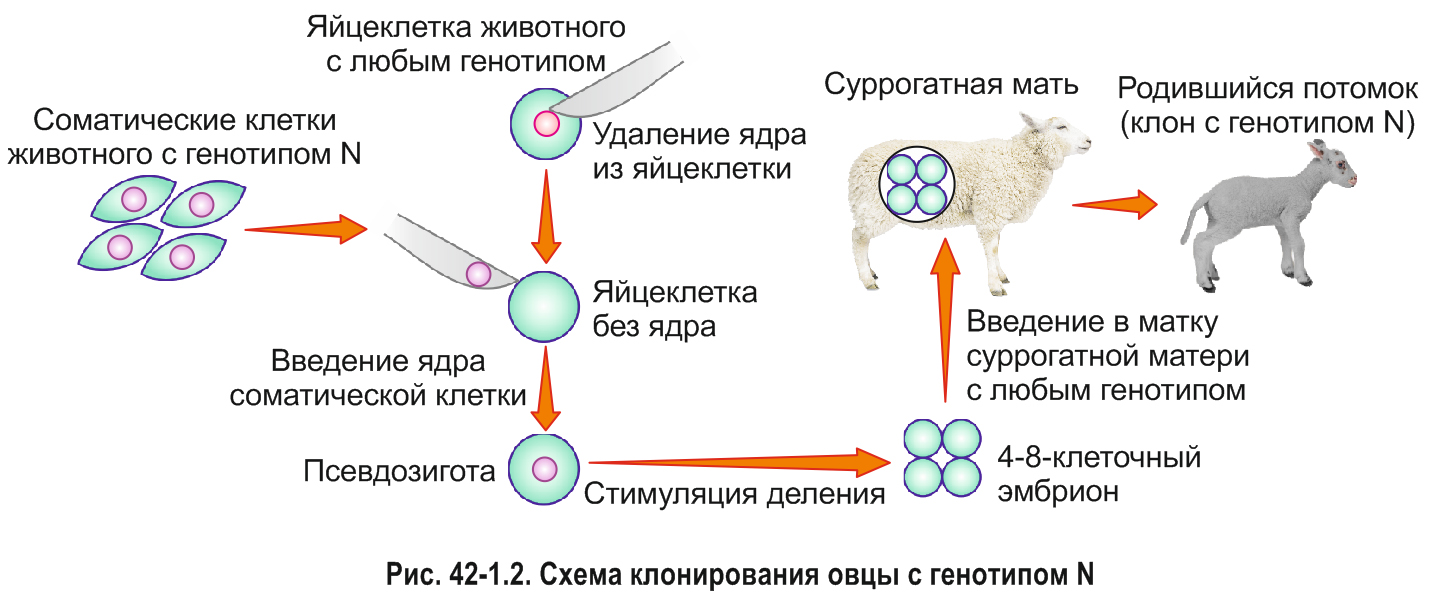
*Для решения проблемы создания таких стад разработан и испытывается метод клонирования животных (не путать с уже известным вам клонированием генов). Так как получение каждого трансгенного животного с нужными свойствами представляет собой сложную задачу, предполагается получать точные генетические копии (клоны) однажды полученных особей. Это можно сделать согласно следующей схеме (рис. 42-1.2).
С помощью специального прибора из яйцеклетки извлекают ее ядро. Затем в нее вводят ядро соматической клетки того животного, которое надо клонировать. Создают условия, при которых такая бывшая яйцеклетка (а теперь псевдозигота), начнет делиться. Как известно, деление зиготы (дробление) — это начало развития эмбриона. Такие эмбрионы переносят в матку суррогатной матери. При удачной трансплантации в стенку матки эмбрион будет развиваться, как обычный плод. В результате родится детеныш — точная генетическая копия того организма, из клетки которого было взято ядро.
Клонировать можно (и нужно!) не только трансгенных животных. В современном животноводстве давно и успешно применяется искусственное осеменение. Для получения высокопродуктивных животных определенной породы используется сперма самцов-производителей. Во множестве хозяйств такой спермой искусственно оплодотворяют половозрелых самок.
Производителями называют тех животных, в генотипе которых обязательно (и желательно в гомозиготном состоянии) присутствуют гены, которые определяют основные породные признаки. Потомки, получаемые от таких производителей, наследуют только половину их высокоценного генотипа. Клонирование же такого производителя может дать точную копию, сохраняющую весь генотип.*
*Животных-производителей определенной породы получают путем многолетней селекции, поэтому их ценность огромна. Например, в 2019 г. на аукционе в штате Северная Дакота (США) одного из племенных быков продали за 1,51 млн долларов.*
В рамках генетической инженерии животных ведутся работы не только по млекопитающим. Разрабатываются более эффективные методы получения трансгенных птиц и рыб.
В селекционной работе с сельскохозяйственной птицей основными направлениями являются получение пород с улучшенным составом мяса и яиц, а также пород, устойчивых к инфекционным заболеваниям. Проводятся эксперименты по созданию птиц-биореакторов, в яйцах которых белок птичий альбумин был бы частично заменен на белок медицинского или ветеринарного назначения.
Для выведения пород рыб также используются методы генетической инженерии. Один из проектов данного направления уже реализован. В генόм атлантического лосося был введен ген гормона роста одного из видов тихоокеанского лосося. Результатом этого стало создание лосося, растущего в 2 раза быстрее, чем рыбы исходной породы (рис. 42-1.3). Еще одним достижением генетической инженерии рыб стало создание пород светящихся в темноте аквариумных рыбок. Для этого были использованы гены медуз и кораллов, которые кодируют светящиеся белки разных цветов (рис. 42-1.4).