§ 3. Органические вещества. Аминокислоты. Олигопептиды
Аминокислоты — мономеры белковых молекул. Аминокислоты — органические соединения, содержащие одновременно аминогруппу (—NН2), обладающую оснóвными свойствами, и карбоксильную группу (—СООН), проявляющую кислотные свойства. В составе живых организмов обнаружены сотни аминокислот, но в образовании белков участвует лишь 20 из них. Такие аминокислоты называют белокобразующими, их полные и сокращенные названия представлены в таблице 3.1 (не для запоминания).
Таблица 3.1. Белокобразующие аминокислоты
|
Аминокислота |
Сокращенное название |
Аминокислота |
Сокращенное название |
|
Аланин |
Ала |
Лейцин |
Лей |
|
Аргинин |
Арг |
Лизин |
Лиз |
|
Аспарагин |
Асн |
Метионин |
Мет |
|
Аспарагиновая кислота |
Асп |
Пролин |
Про |
|
Валин |
Вал |
Серин |
Сер |
|
Гистидин |
Гис |
Тирозин |
Тир |
|
Глицин |
Гли |
Треонин |
Тре |
|
Глутамин |
Глн |
Триптофан |
Трп |
|
Глутаминовая кислота |
Глу |
Фенилаланин |
Фен |
|
Изолейцин |
Иле |
Цистеин |
Цис |
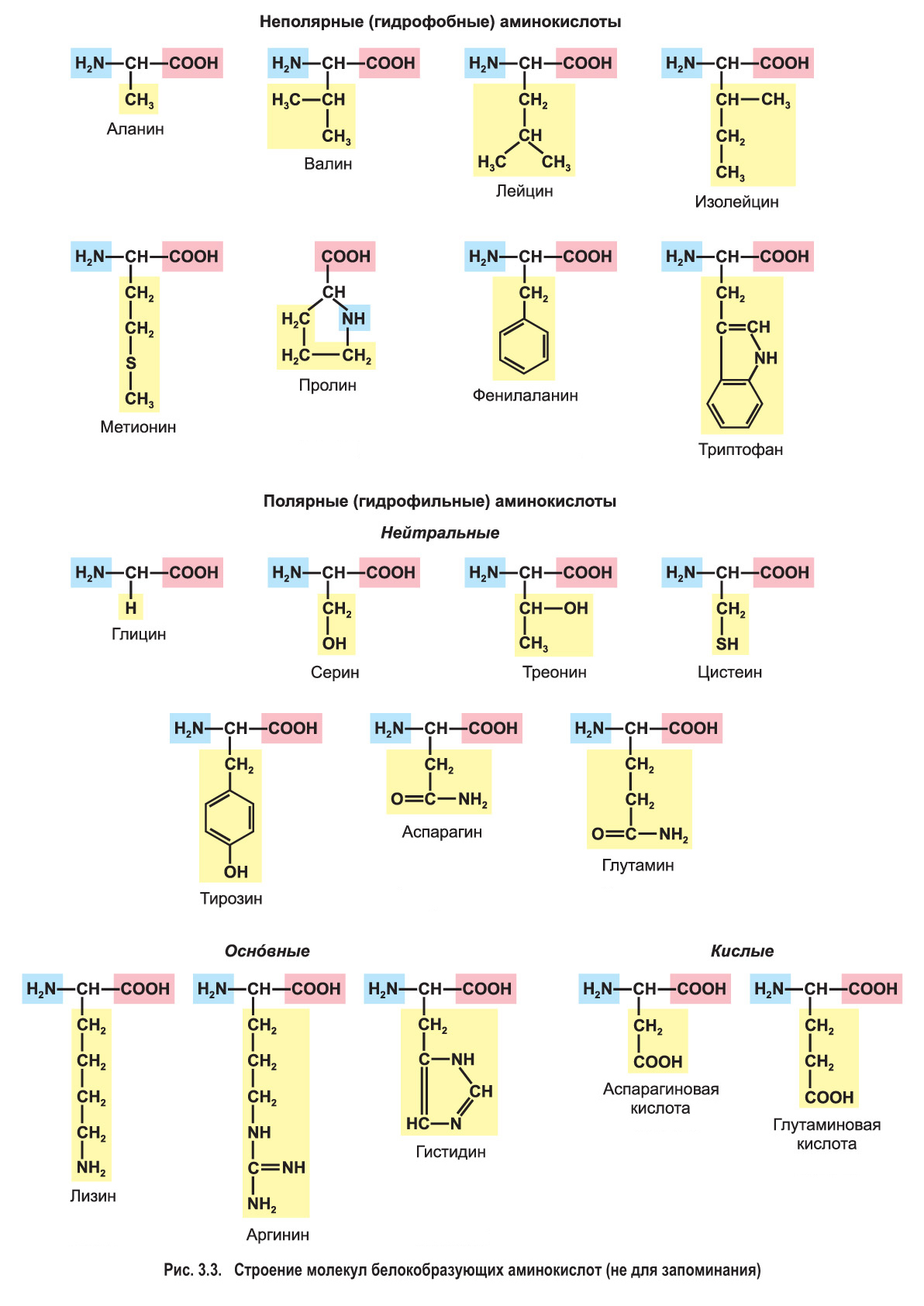
В молекулах белокобразующих аминокислот аминогруппа и карбоксильная группа присоединены к одному и тому же атому углерода (т. е. все они являются α-аминокислотами). С этим же атомом углерода связан радикал (R), который у каждой аминокислоты имеет особое строение и определяет ее специфические свойства (рис. 3.2).
Радикалы аминокислот могут быть неполярными (гидрофобными) или полярными (гидрофильными), содержать различные функциональные группы. Например, радикал серина содержит гидроксильную группу (—ОН), радикал цистеина — серосодержащую группу (—SH). Некоторые аминокислоты имеют циклические радикалы (рис. 3.3). Все это играет важную роль в формировании пространственной структуры белков.
Молекулы большинства белокобразующих аминокислот содержат одну аминогруппу и одну карбоксильную группу — это нейтральные аминокислоты. Некоторые аминокислоты имеют дополнительные амино- или карбоксильные группы в составе радикала. Такие аминокислоты соответственно называются оснóвными или кислыми (см. рис. 3.3).
Автотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофных организмов источником аминокислот является пища. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми. Другие же, так называемые незаменимые аминокислоты, не могут быть синтезированы в организме и поэтому должны постоянно поступать в него в составе белков пищи.
*Полноценные пищевые белки содержат остатки всех незаменимых аминокислот. Белки пищи, в составе которых отсутствуют остатки каких-либо незаменимых аминокислот, называют неполноценными.*
Для человека незаменимыми аминокислотами являются: триптофан, валин, лизин, изолейцин, треонин, фенилаланин, метионин и лейцин. Запоминать их перечень необязательно, но при желании можете воспользоваться мнемоническими правилами. Например: «ТРи Подруги — ВАЛя, ЛИЗа И ЛЕнка ТРЕбовали ФЕН и МЕТаллическую ЛЕЙку».
*Частично заменимые аминокислоты — аргинин и гистидин — синтезируются у человека в небольшом количестве, недостаточном для нормального функционирования организма, особенно в детском возрасте. Поэтому они должны дополнительно поступать в составе пищевых белков.*
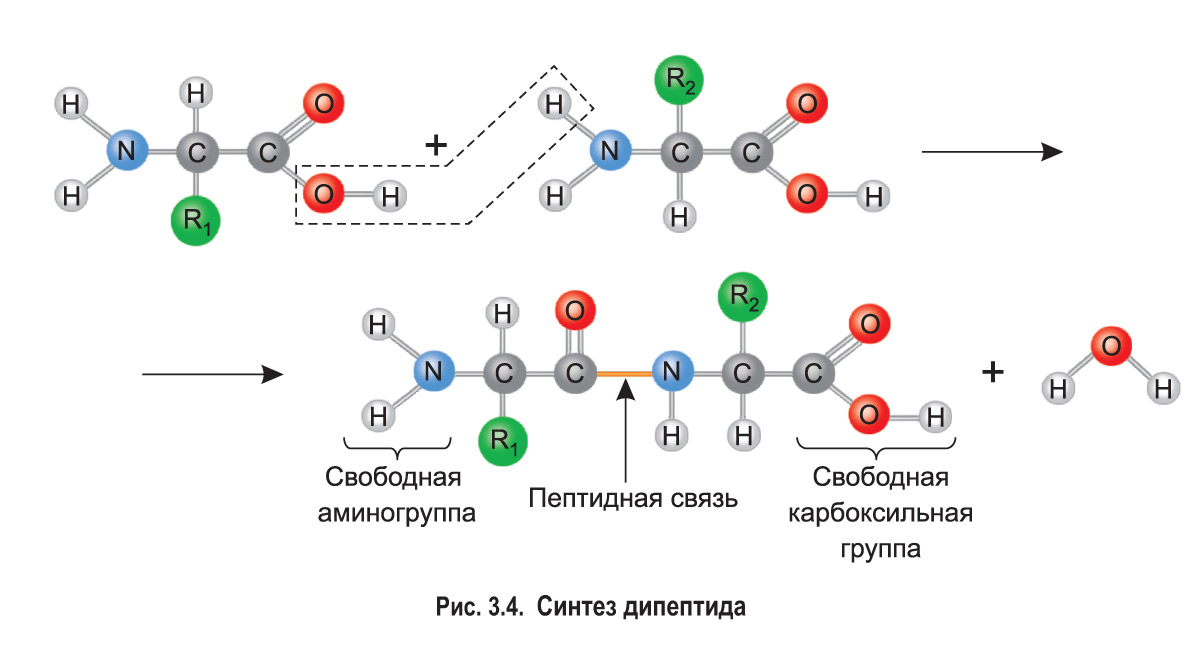
Наличие одновременно аминогруппы и карбоксильной группы обусловливает амфотерность аминокислот и их высокую реакционную способность. Как вы помните из курса химии, карбоксильная группа (—СООН) одной аминокислоты может взаимодействовать с аминогруппой (—NH2) другой аминокислоты. При этом от карбоксильной группы отщепляется группа —ОН, а от аминогруппы — атом водорода. В результате выделяется молекула воды, а между атомом углерода карбоксильной группы и атомом азота аминогруппы возникает ковалентная связь, которая называется пептидной связью (рис. 3.4).
Так образуется дипептид, который имеет на одном конце свободную аминогруппу, а на другом — свободную карбоксильную группу. Поэтому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды и далее полипептиды.
*Структуру олиго- и полипептидов принято записывать слева направо в направлении от конца, содержащего свободную аминогруппу (так называемый N-конец), к концу, имеющему свободную карбоксильную группу (С-конец). Например, дипептиды Глу—Ала и Ала—Глу имеют различную структуру: у первого остаток глутаминовой кислоты имеет свободную группу —NH2, а остаток аланина — группу —СООН, а у второго — наоборот.*