§ 49. Жалеза і яго злучэнні
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 49. Жалеза і яго злучэнні |
| Напечатано:: | Гость |
| Дата: | Среда, 13 Август 2025, 19:48 |
Жалеза як хімічны элемент

Жалеза — элемент, размешчаны ў 4-м перыядзе, VIIIB-групе перыядычнай сістэмы. Электронная схема, формула электроннай канфігурацыі маюць выгляд:
![]() або 26Fe 2е–, 8е–, 14е–, 3е–;
або 26Fe 2е–, 8е–, 14е–, 3е–;
26Fe 1s22s22p63s23p64s23d6 або 26Fe [Ar]3d64s2;
26Fe 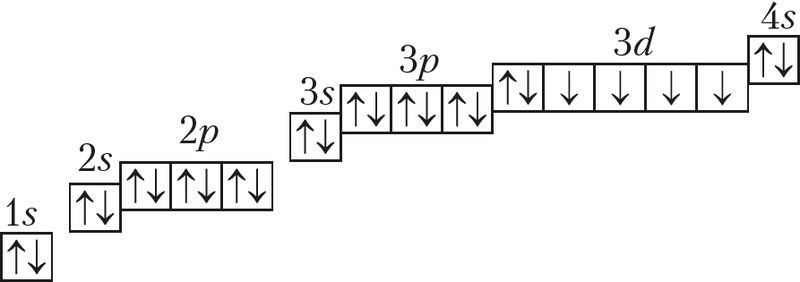
Жалеза адносіцца да d-элементаў. Найбольш устойлівымі ступенямі акіслення атамаў жалеза з’яўляюцца +2 і +3.
Жалеза — другі па распаўсюджанасці пасля алюмінію метал у зямной кары (масавая доля — каля 5 %). У неакісленым стане жалеза зрэдку сустракаецца ў метэарытах у саставе сплаву з кобальтам і нікелем. У прыродзе жалеза знаходзіцца ў выглядзе злучэнняў. Найбольш распаўсюджанымі мінераламі, якія ўтрымліваюць жалеза, з’яўляюцца Fe2O3 (гематыт), Fe3O4 (магнетыт), FeO(OH) (гётыт), FeS2 (пірыт), FeCO3 (сідэрыт).
У Рэспубліцы Беларусь адкрыты два радовішчы жалезных руд — Навасёлкаўскае (Карэліцкі раён Гродзенскай вобласці) і Аколаўскае (Стаўбцоўскі раён Мінскай вобласці). Іх разглядаюць у якасці магчымай сыравіннай базы для металургічнай прамысловасці нашай краіны. Галоўны рудны мінерал гэтых радовішчаў — магнетыт.
Жалеза як простае рэчыва
Фізічныя ўласцівасці. Жалеза ўяўляе сабой светлы серабрыста-белы метал са шчыльнасцю 7,87 г/см3 і тэмпературай плаўлення 1538 °С. Метал пластычны, адносна мяккі: яго адносная цвёрдасць па шкале Моаса роўная 4 (Дадатак 2).
Пры чырвоным напале (вышэй за 600 °С) жалеза размякчаецца і добра паддаецца зварцы, коўцы і пракатцы. Адметнай асаблівасцю жалеза з’яўляюцца яго ярка выражаныя магнітныя ўласцівасці — ферамагнетызм.
Магнітнымі ўласцівасцямі, акрамя жалеза, валодаюць кобальт, нікель і некаторыя сплавы гэтых металаў, а таксама прыродны мінерал магнетыт. Ферамагнетыкі выкарыстоўваюць у электрагенератарах, трансфарматарах, для гука- і відэазапісу, у тэлефонах, камп’ютарах і інш.
Хімічныя ўласцівасці. Па хімічных уласцівасцях металічнае жалеза — тыповы метал. Успомнім асаблівасці вядомых вам узаемадзеянняў жалеза з неметаламі, вадзяной парай, кіслотамі і солямі (табл. 35).
Табліца 35. Хімічныя ўласцівасці жалеза
| Рэагенты і ўраўненні (схема) рэакцый | Умовы працякання і прадукт рэакцыі |
| Жалеза пры награванні ўзаемадзейнічае з неметаламі (азотам, борам, крэмніем, фосфарам, серай). Галагены акісляюць жалеза да ступені акіслення +3 (акрамя I2). Пры гарэнні жалеза ў кіслародзе ўтвараецца аксід Fe3О4, у якім знаходзяцца атамы жалеза(II) і жалеза(III) | |
| Пры высокай тэмпературы (каля 800 °С) жалеза аднаўляе вадарод з вадзяной пары | |
| Жалеза здольнае аднаўляць вадарод з кіслот. Пры пакаёвай тэмпературы жалеза ў канцэнтраваных HNО3, H2SО4 не раствараецца, паколькі яны пасівіруюць яго паверхню | |
| Жалеза аднаўляе менш актыўныя металы з раствораў солей | |
Карозія жалеза
Вырабы з жалеза ў тэхніцы, побыце падвяргаюцца карозіі. Карозія — разбурэнне металу ў выніку ўзаемадзеяння з рэчывамі з навакольнага асяроддзя.
Прычыны карозіі. Умоўна працэс карозіі жалеза ў вільготнай атмасферы можна выразіць ураўненнем:
.
Гідраксід жалеза(III) Fe(OH)3, які ўтвараецца, падвяргаецца частковай дэгідратацыі — выдаленню вады — і таму састаў іржы выражаюць формулай Fe2O3 · xH2O.
Пры высокіх тэмпературах можа адбывацца акісленне сухім кіслародам з утварэннем Fe3O4:
.
У навакольным асяроддзі ў прысутнасці іншых акісляльнікаў, напрыклад кіслот і кіслотных аксідаў, утвараюцца солі жалеза.
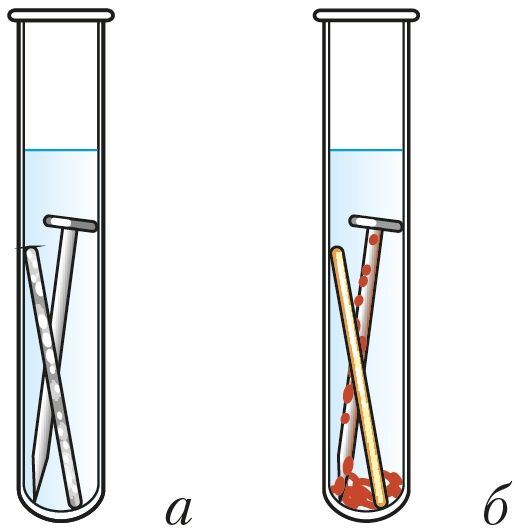
Ва ўсіх гэтых працэсах жалеза акісляецца і разбураецца, кампаненты навакольнага асяроддзя аднаўляюцца. Прадукты акіслення жалеза ўтвараюцца ў выглядзе рыхлых слаёў, якія не засцерагаюць метал ад далейшай карозіі (§ 20, мал. 47, б).
Скорасць карозіі, як і ў выпадку іншых акісляльна-аднаўленчых працэсаў, залежыць ад хімічнай прыроды і плошчы судакранання рэагентаў, іх канцэнтрацыі, тэмпературы. Карозію паскараюць растворы солей і кіслот (мал. 113). Карозію запавольваюць, паліруючы паверхню металу, захоўваючы метал у сухім паветры. Карозія жалеза запавольваецца ў растворы шчолачаў або пры кантакце з больш актыўным, чым жалеза, металам (мал. 114).
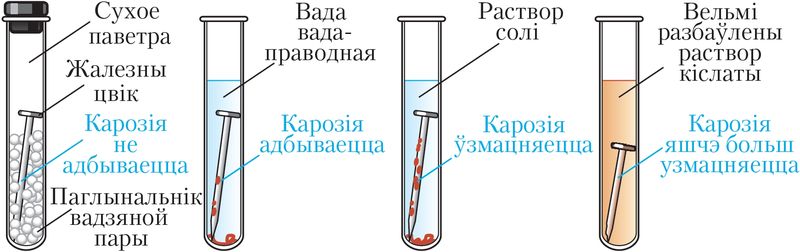
З курсу хіміі 9-га класа вам вядома, што скорасць карозіі павялічваецца пры кантакце жалеза з менш актыўным металам (мал. 114).
Веданне фактараў, якія ўплываюць на скорасць карозіі, дазволіла прапанаваць шэраг спосабаў аховы ад карозіі.
1. Ахоўныя пакрыцці. У якасці матэрыялаў для металічных пакрыццяў прымяняюць цынк, нікель, медзь, хром, серабро, бронзу, латунь і інш. (мал. 115). Так, ацынкаванае жалеза выкарыстоўваюць у якасці матэрыялу для даху, у вырабе кузаваў аўтамабіляў, шрубаў. У гэтым выпадку жалеза не будзе разбурацца да таго часу, пакуль не прарэагуе ўсё пакрыццё з цынку. Пакрыцці з менш актыўных металаў, чым жалеза, ахоўваюць яго ад карозіі толькі ў выпадку, калі ў іх адсутнічаюць поры, трэшчыны, драпіны.

Да неметалічных пакрыццяў адносяць лакафарбавыя і палімерныя матэрыялы, змазачныя алеі.
Ахоўныя пакрыцці таксама атрымліваюць шляхам аксідзіравання (стварэнне слоя акаліны Fe3O4) і фасфаціравання (нанясенне слоя фасфатаў) паверхні металу.
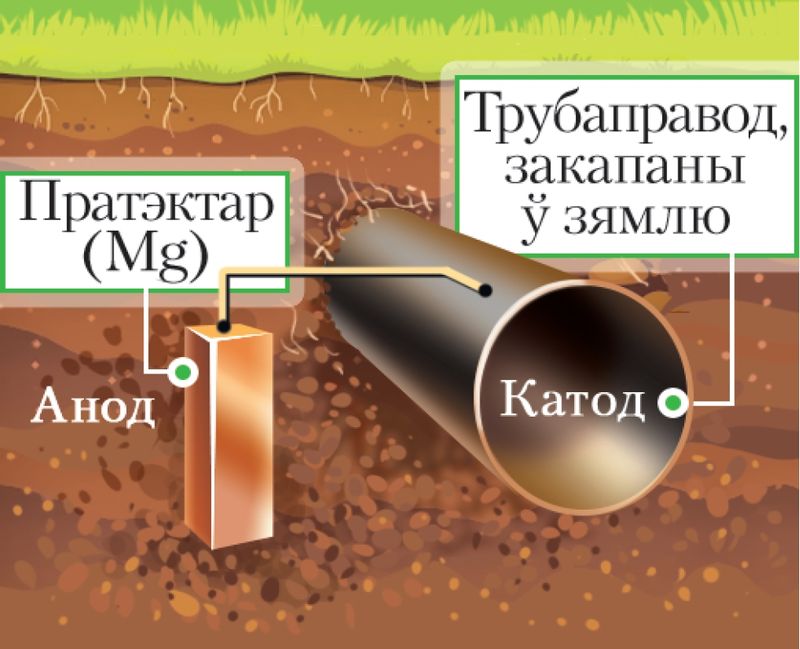
2. Электрахімічная ахова ажыццяўляецца падключэннем ахоўнай канструкцыі да адмоўнага полюса знешняй крыніцы пастаяннага току (катодная ахова) або прывядзеннем металу, які ахоўваецца, у кантакт з больш актыўным металам (мал. 116).
3. Легіраванне металаў. У расплаў металу пры яго вытворчасці дадаюць легіравальныя дабаўкі — хром, нікель, малібдэн і інш., якія зніжаюць актыўнасць металу. Такім чынам атрымліваюць, напрыклад, нержавеючую сталь.
4. Змяненне саставу і ўласцівасцей каразійнага асяроддзя. Каразійнае асяроддзе можна змяніць дабаўленнем у яе інгібітараў (рэчываў, якія значна памяншаюць скорасць карозіі металаў, напрыклад нітрыту, фасфату або храмату натрыю і шэрага іншых).

Прымяненне жалеза і яго сплаваў. Да 95 % усяго здабыванага жалеза вырабляецца ў выглядзе яго сплаваў — чыгуну і сталі. З саставам, уласцівасцямі і сферамі прымянення гэтых сплаваў вы ўжо пазнаёміліся, вывучаючы матэрыял § 43, а з метадамі атрымання — § 45. Нагадаем, што ў сталі вугляроду ўтрымліваецца менш за 2 %, гэта значыць значна менш, чым у чыгуне, таму сталь — больш коўкі, трывалы і менш крохкі сплаў у параўнанні з чыгуном. Яна лёгка падвяргаецца механічнай апрацоўцы (рэжацца, шліфуецца, пракатваецца, паддаецца коўцы).
Чыгун — больш танны сплаў з добрымі ліцейнымі ўласцівасцямі, але больш крохкі. Вырабы з чыгуну больш каразійнаўстойлівыя, чым з нелегіраванай сталі (мал. 117). Адрозненне ва ўласцівасцях вызначыла і розныя галіны выкарыстання сплаваў жалеза.
Чыстае жалеза прымяняецца як каталізатар, напрыклад у сінтэзе аміяку, браміраванні бензолу.
Жалеза адносіцца да d-элементаў. Найбольш устойлівыя ступені акіслення атамаў жалеза +2 і +3.
Жалеза рэагуе з неметаламі, вадзяной парай, кіслотамі і солямі.
Вырабы з жалеза і яго сплаваў падвяргаюцца карозіі — разбурэнню ў выніку ўзаемадзеяння з рэчывамі з навакольнага асяроддзя. Яе можна запаволіць нанясеннем пакрыццяў, прывядзеннем у кантакт з больш актыўным металам, легіраваннем металу або змяненнем саставу і ўласцівасцей каразійнага асяроддзя.
Пытанні, заданні, задачы
1. Складзіце формулу электроннай канфігурацыі і электронна-графічную схему жалеза. Пакажыце лік няспараных электронаў у асноўным стане атама жалеза.
2. Кансервавыя бляшанкі часта пакрываюць волавам. Гэты працэс называюць луджэннем. Пры з’яўленні драпін на волаве карозія бляшанкі працякае хутчэй, чым ацынкаванага жалеза. Як гэта можна растлумачыць, карыстаючыся становішчам металаў у радзе актыўнасці?
3. Якія заклёпкі — медныя або алюмініевыя — лепш выкарыстоўваць для змацоўвання дзвюх жалезных дэталей?
4. Чаму нельга рыхтаваць раствор меднага купарвасу ў жалезным вядры?
5. Тры жалезныя пласцінкі цалкам апусцілі ў разбаўленыя растворы гідраксіду калію, хларыду калію, воцатнай кіслаты, а чацвёртую — у дыстыляваную ваду. Апішыце, што будзе назіраць эксперыментатар праз суткі.
6. Вызначце масу сярэдняй солі, якая ўтварылася пры ўзаемадзеянні жалеза масай 11,2 г з дастатковай колькасцю разбаўленай сернай кіслаты.
7. Складзіце ўраўненні рэакцый аксідаў жалеза FeО, Fe2О3 і Fe3О4 з вадародам, разбаўленымі сернай і салянай кіслотамі.
8. Пакажыце кірунак зрушвання раўнавагі ў сістэме
:
- а) пры павышэнні ціску;
- б) павышэнні тэмпературы;
- в) павелічэнні канцэнтрацыі чаднага газу.
9. Жалезную пласцінку масай 10 г вытрымалі ў растворы меднага купарвасу, што ўтрымліваў cульфат медзі(II) масай 2,4 г. Вызначце масу пласцінкі пасля заканчэння рэакцыі.
10. З кожнай тоны жалезнай руды, у якой масавая доля Fe3O4 роўная 82 %, атрыманы чыгун масай 575 кг з масавай доляй жалеза 95,5 %. Вызначце выхад жалеза.
*Самакантроль
1. У атаме жалеза ў асноўным стане ёсць:
- а) чатыры няспараныя электроны;
- б) запоўненая 4s-арбіталь;
- в) шэсць р-электронаў;
- г) вакантныя 4р-арбіталі.
2. Карозія жалеза ўзмацняецца:
- а) пры кантакце з цынкам;
- б) у растворах солей;
- в) пры фасфатаванні яго паверхні;
- г) з павелічэннем вільготнасці паветра.
3. Пры пакаёвай тэмпературы жалеза рэагуе з:
- а) HNO3(разб);
- б) HСl(канц);
- в) H2SO4(разб);
- г) H2SO4(канц);
4. У рэакцыі жалеза з вадзяной парай асноўным прадуктам з’яўляецца:
- а) FeO;
- б) Fe2O3;
- в) Fe3O4;
- г) Fe(OH)3.
5. Жалеза пры ўзаемадзеянні з хлорам і салянай кіслатой утварае адпаведна:
- а) FeCl2 і FeCl3;
- б) FeCl3 і FeCl3;
- в) FeCl3 і FeCl2;
- г) FeCl2 і FeCl2.