§ 43. Металы. Агульная характарыстыка
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 43. Металы. Агульная характарыстыка |
| Напечатано:: | Гость |
| Дата: | Среда, 9 Июль 2025, 09:16 |
Металы — гэта крышталічныя простыя рэчывы з металічнай сувяззю паміж шчыльна ўпакаванымі атамамі.
У табліцы перыядычнай сістэмы металы размешчаны лявей ад умоўнай ступеньчатай лініі (гл. мал. 61). Да металаў адносяцца s-элементы (акрамя H і He), частка p-элементаў і ўсе d- і f-элементы.
Асаблівасці электроннай будовы атамаў металаў
У атамаў металаў лік электронаў на знешнім слоі ў асноўным складае ад 1 да 3. Выключэннем з’яўляюцца ўсяго некалькі металаў: Ge, Sn, Pb (4 электроны); Sb, Bi (5 электронаў); Po (6 электронаў). У перыядзе ў атамаў металаў большы радыус, чым у неметалаў, паколькі сілы кулонаўскага ўзаемадзеяння электронаў з ядром невялікія.

Нагадаем, што па структуры крышталёў і электрафізічных уласцівасцях германій і адна з алатропных мадыфікацый волава з’яўляюцца паўправаднікамі.
Электронныя канфігурацыі знешняй электроннай абалонкі атамаў s-элементаў 2-га і 3-га перыядаў, а таксама p-элемента 3-га перыяду Al прыведзены ў раздзеле II, табліцы 6 і Дадатку 1. Атамы элементаў IА- і IIА-груп 2–7-га перыядаў маюць электронную канфігурацыю ns1 і ns2 адпаведна. Металы — гэта і p-элементы IIIА–VIА-груп 3–7-га перыядаў (Al, Ga, In, Tl, Sn, Pb, Sb, Bi, Po); іх электронныя канфігурацыі ns2np1, ns2np2, ns2np3, ns2np4.
У перыядычнай сістэме ў кожным перыядзе, пачынаючы з 4-га і да 7-га, маецца па 10 d-элементаў, у атамаў якіх з ростам парадкавага нумара паслядоўна запаўняюцца пяць d-арбіталей.
Звернем увагу, што энергія 3d-падузроўню вышэйшая, чым 4s-падузроўню. Таму d-электроны могуць прымаць удзел ва ўтварэнні хімічных сувязей, гэта значыць атамы d-элементаў маюць большы лік валентных электронаў у параўнанні з атамамі s- і p-элементаў, якія адносяцца да металаў.
Знаёмыя вам прыклады d-элементаў — Fe (элемент VIIIB-групы 4-га перыяду, формула электроннай канфігурацыі 1s22s22p63s23p63d64s2), а таксама Cu (элемент IB-групы 4-га перыяду, формула электроннай канфігурацыі 1s22s22p63s23p63d104s1).
Пачынаючы з 6-га перыяду ў перыядычнай сістэме з’яўляюцца f-элементы, якія аб’яднаны ў сямействы па 14 элементаў (за кошт падобных хімічных уласцівасцей) і носяць асобыя назвы лантаноідаў і актыноідаў.
Пры ўтварэнні металічнай сувязі атамы металаў лёгка абагульняюць свае валентныя электроны. Электроны належаць не асобным атамам, а з’яўляюцца агульнымі для ўсіх атамаў і свабодна перамяшчаюцца па ўсім крышталі (гл. раздз. 3, мал. 26). Металічная сувязь уласціва металам у вадкім і цвёрдым агрэгатным станах.
Знаходжанне металаў у прыродзе
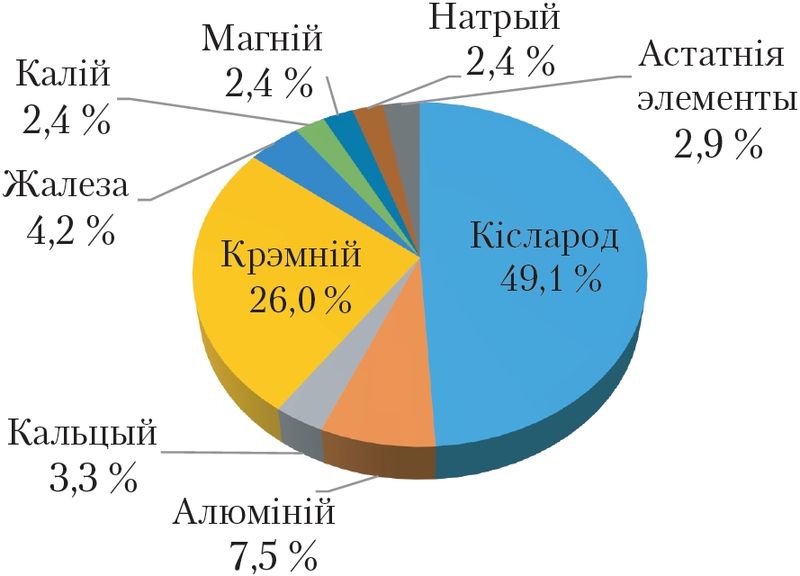
На долю металаў прыходзіцца 25 % масы зямной кары і 3–5 % масы цела чалавека. У зямной кары самым распаўсюджаным металам з’яўляецца алюміній (мал. 102).
Формы знаходжання металаў у прыродзе суадносяцца з хімічнай актыўнасцю іх простых рэчываў. Найбольш актыўныя металы існуюць у прыродзе, як правіла, у выглядзе солей — хларыдаў, сульфатаў, карбанатаў, фасфатаў, сілікатаў (NaCl, KCl, MgSO4 · 7H2O, CaCO3, Ca3(PO4)2), алюмасілікатаў. Металы сярэдняй актыўнасці прадстаўлены ў прыродзе часцей за ўсё аксідамі і сульфідамі (Fe2O3, Fe3O4, ZnS, CuFeS2, PbS, Cr2O3). Металы нізкай актыўнасці (Сu, Ag, Au, Pt) сустракаюцца ў прыродзе ў свабодным стане. Многія мінералы маюць складаны састаў і ўключаюць катыёны двух-трох розных металаў і аніёны розных кіслотных астаткаў неарганічных кіслот і гідраксільныя групы (Дадатак 2).
У крыві чалавека выяўлена больш за 60 хімічных элементаў-металаў. У арганізме чалавека прысутнічаюць макраэлементы — калій, кальцый, натрый, магній, а ў меншых колькасцях мікраэлементы — алюміній, жалеза, марганец, медзь, цынк і іншыя.
Фізічныя ўласцівасці металаў
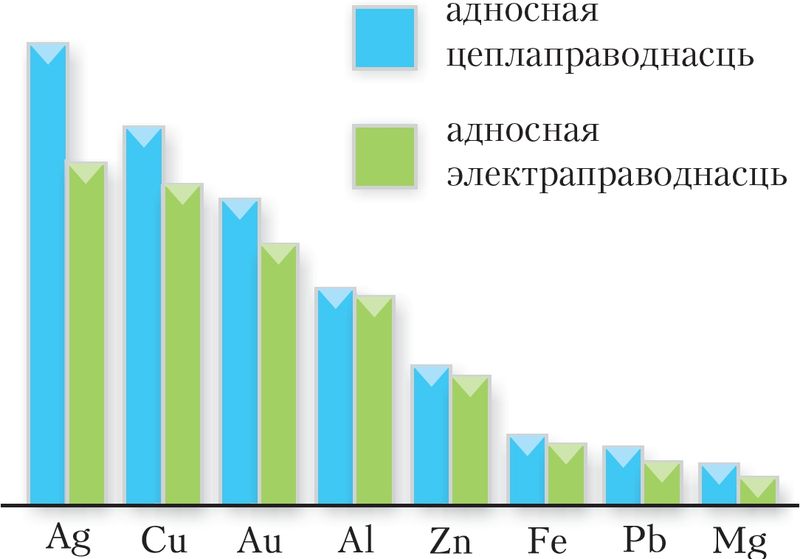
Для металаў характэрны высокія цепла- і электраправоднасць, пластычнасць (коўкасць) і металічны бляск (§ 11, табл. 8). Адметнай рысай электраправоднасці металаў з’яўляецца яе залежнасць ад тэмпературы: з павелічэннем тэмпературы іх электраправоднасць памяншаецца. Пры гэтым яна ў 1014 разоў і болей перавышае электраправоднасць дыэлектрыкаў. Найбольш высокай электра- і цеплаправоднасцю валодаюць серабро, золата, медзь і алюміній, самай нізкай — ртуць і вісмут (мал. 103).
Пластычнасць (коўкасць) металаў выяўляецца ў іх здольнасці змяняць форму пры ціску, выцягвацца ў дрот, пракатвацца ў тонкія лісты (мал. 104). Пластычнасць металаў тлумачыцца тым, што шчыльна выкладзеныя слаі атамаў металу могуць слізгаць адносна адзін аднаго, не разбураючы хімічныя сувязі, якія іх аб’ядноўваюць (гл. § 16, мал. 39). Па пластычнасці металы падзяляюць на высокапластычныя (па ўбыванні) — Au, Ag, Pb, Cu, Fe, Ti, Sn, Al; пластычныя — Mg, Zn, Mo, W; крохкія — Cr, Mn, Sb.

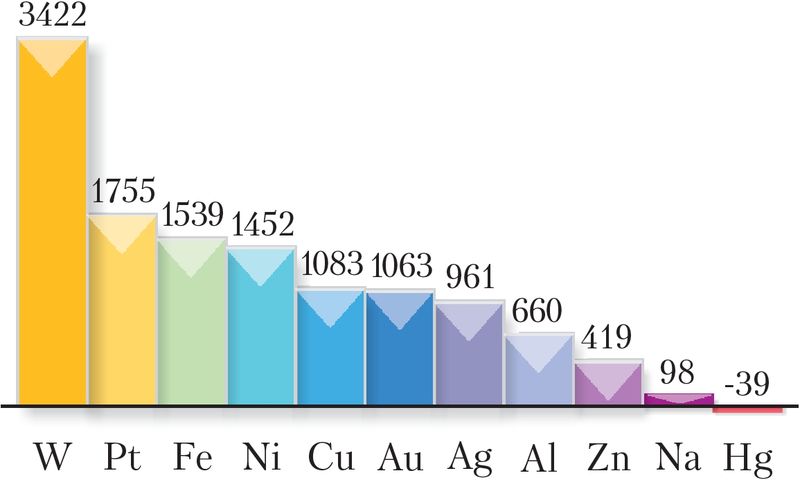
Па агрэгатным стане пры пакаёвай тэмпературы ўсе металы, за выключэнне ртуці, — цвёрдыя рэчывы з крышталічнай структурай. Тэмпературы плаўлення металаў знаходзяцца ў дыяпазоне ад –39 °C (ртуць) да 3422 °C (вальфрам) (мал. 105).
Па шчыльнасці металы дзеляць на цяжкія і лёгкія. Прыкладамі лёгкіх металаў служаць калій (ρ = 0,9 г/см3), алюміній (ρ = 2,7 г/см3). Да цяжкіх адносяцца металы, размешчаныя ў перыядычнай сістэме за жалезам, напрыклад, свінец, ртуць, золата. У цяжкіх металаў шчыльнасць большая за 7,8 г/см3. Так, шчыльнасць золата складае 19,3 г/см3.
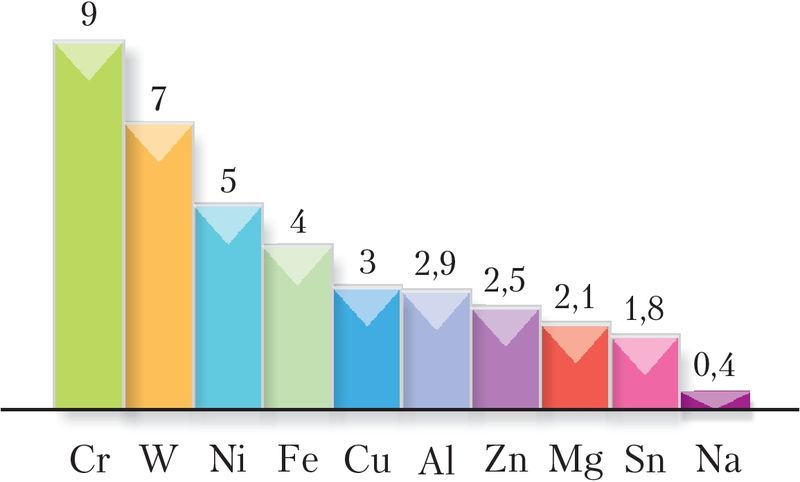
Самыя цвёрдыя металы — вальфрам, хром, тытан, малібдэн (мал. 106). Цвёрдасць хрому і вальфраму набліжаецца да цвёрдасці карунду (Дадатак 2). Да мяккіх металаў адносяцца, напрыклад, натрый і калій. Іх зліткі можна разрэзаць нажом.
Паліраваная паверхня металаў мае характэрны металічны бляск. Дзякуючы гэтай уласцівасці тонкія пласты серабра або алюмінію на гладкай паверхні, напрыклад шкла, выкарыстоўваюць для вырабу люстэркаў.
Сплавы металаў, іх састаў, уласцівасці, прымяненне
У тэхніцы і побыце звычайна выкарыстоўваюць не індывідуальныя металы, а іх сплавы. Найбольш часта сплавы атрымліваюць металургічным шляхам, расплаўляючы механічныя сумесі двух і больш металаў або сумесі металаў з неметаламі. Атрыманыя расплавы вытрымліваюць пры пэўнай тэмпературы для працякання ўзаемадзеяння кампанентаў, а потым крышталізуюць.
Пад металічнымі сплавамі разумеюць матэрыялы, якія маюць металічныя ўласцівасці і складаюцца з двух або большага ліку хімічных элементаў, з якіх хаця б адзін з’яўляецца металам.
Уласцівасці сплаву залежаць ад прыроды і колькасных суадносін кампанентаў, метаду атрымання і апрацоўкі. Супаставім такія ўласцівасці індывідуальных металаў і сплаваў, як тэмпература плаўлення, цвёрдасць і шчыльнасць.
Сплавы часта адрозніваюцца больш нізкімі тэмпературамі плаўлення ў параўнанні з індывідуальнымі металамі. Напрыклад, чысты свінец плавіцца пры тэмпературы +327,5 °С, а чыстае волава — пры +232 °С. Сплаў на аснове волава, які ўтрымлівае 36 % свінцу, мае тэмпературу плаўлення +181 °С. Сплавы звычайна цвярдзейшыя за чысты метал, іх электра- і цеплаправоднасць меншая. Многія сплавы вядомы чалавеку са старажытных часоў. Першыя металічныя прадметы, якія ўдалося знайсці археолагам, былі зроблены з бронзы — сплаву, які даў назву цэлай эпосе развіцця чалавецтва. Шчыльнасць сплаваў звычайна мае прамежкавае значэнне паміж шчыльнасцямі індывідуальных кампанентаў сплаву.
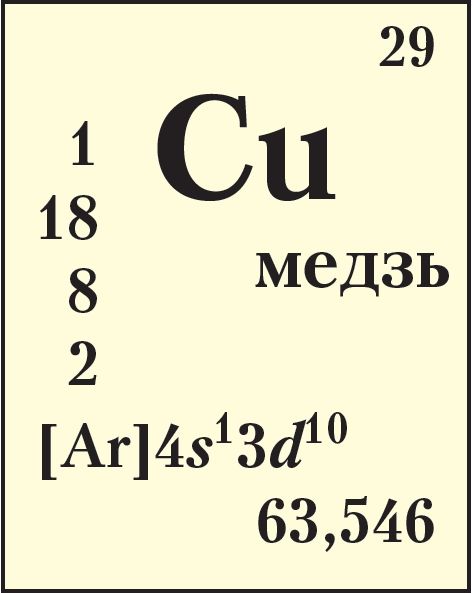
Бронзай называюць сплавы медзі з іншымі металамі, напрыклад волавам, жалезам, алюмініем і інш., акрамя цынку і нікелю. Найбольш распаўсюджаныя алавяністыя бронзы — сплавы Cu—Sn, у якіх утрыманне волава дасягае некалькіх працэнтаў, а часам і болей. Сплаў медзі з цынкам з розным утрыманнем цынку, нават да 50 %, называюць латунню. Дзякуючы ўстойлівасці да механічнага сцірання і высокай каразійнай стойкасці бронзу і латунь выкарыстоўваюць для вырабу дэталей машын і прыбораў, рознай фурнітуры, труб. Бронзу прымяняюць у ліцці скульптур і помнікаў. Нам усім знаёмыя бронзавыя люстры і статуэткі, латуневыя краны, самавары, дзвярныя ручкі (мал. 107).

На дадзеным этапе развіцця цывілізацыі найбольш пашыраны метал — жалеза, але яго не выкарыстоўваюць у чыстым выглядзе. Цвёрдасць чыстага жалеза невялікая. Акрамя таго, яно хутка акісляецца на паветры, асабліва ў вільготнай атмасферы, ад чаго вырабы з яго прыходзяць у непрыдатнасць. Таму выкарыстоўваюць сплавы жалеза, якія ўтрымліваюць вуглярод і прымесі іншых металаў. Пры ўтрыманні вугляроду больш за 2 % па масе — гэта чыгуны, менш за 2 % — сталі.
Дзякуючы добрым ліцейным якасцям, трываласці, невялікаму каэфіцыенту трэння і многім іншым карысным уласцівасцям чыгун выкарыстоўваюць для вырабу дэталей арматуры, падмуркаў станкоў, падшыпнікаў, катлоў і многіх іншых вырабаў машына-, трактара- і станкабудавання. Сталь у параўнанні з чыгуном больш пластычная, трывалая, цвёрдая, лягчэй апрацоўваецца механічна. Некаторыя яе гатункі, што ўтрымліваюць прымесі Cr, Ni, Mo, Ti, больш каразійнаўстойлівыя. Сплавы жалеза з нікелем, хромам і іншымі металамі (да некалькіх працэнтаў), якія змяшчаюць менш за 2 % вугляроду, незаменныя пры вырабе будаўнічых канструкцый, дэталей машын, рэек, рэжучага інструменту, арматуры (мал. 107).
Дзюралюміній — сплаў алюмінію (94 %) з меддзю, магніем і марганцам — асноўны канструкцыйны матэрыял у авіяцыі, касманаўтыцы, вытворчасці хуткасных цягнікоў, аўтамабіляў і ў іншых галінах прамысловасці, для якіх прынцыповую ролю адыгрывае мінімальная маса канструкцыі. Гэты сплаў адрозніваецца не толькі лёгкасцю, але і трываласцю (гл. мал. 107).
Сплаў вальфраму з кобальтам і вугляродам (пабедыт) па цвёрдасці блізкі да алмазу. З яго вырабляюць звыштрывалыя інструменты для металаапрацоўкі і бурэння горных парод, свердлаў па бетоне.
Чыстае золата — мяккі метал, таму ў ювелірных вырабах выкарыстоўваюць яго больш цвёрдыя сплавы, напрыклад, з меддзю, нікелем. Дадаванне ў золата іншых металаў змяняе не толькі яго механічныя ўласцівасці, але і колер. Напрыклад, пры ўтрыманні паладыю больш за 10 % золата афарбоўваецца ў белы колер з лёгкім цялесным адценнем.
Металы — гэта крышталічныя рэчывы з металічнай сувяззю паміж шчыльна ўпакаванымі атамамі.
Для металаў характэрны высокія цепла- і электраправоднасць, высокая пластычнасць (коўкаць) і металічны бляск.
Металічныя сплавы — гэта матэрыялы, якія маюць металічныя ўласцівасці і складаюцца з двух або большай колькасці хімічных элементаў, з якіх хаця б адзін з’яўляецца металам.
Пытанні, заданні, задачы
1. Назавіце і патлумачце:
- а) агульныя фізічныя ўласцівасці металаў;
- б) найважнейшыя фізічныя адрозненні сплаваў ад індывідуальных металаў.
2. Прывядзіце электронныя канфігурацыі атамаў, параўнайце радыусы атамаў:
- а) натрыю і літыю;
- б) магнію і аргону.
3. Растлумачце, чаму пры моцным марозе за металічную дзвярную ручку, у адрозненне ад драўлянай, голай рукой брацца не рэкамендуецца.
4. Вызначце ступені акіслення атамаў металаў у злучэннях: MgS, NaNO3, FeO, Fe2O3, Cr2O3, CrO3.
5. Расстаўце сімвалы металаў у парадку ўзрастання радыусу іх атамаў: Mg, Na, Li, Fr, Ba.
6. Выкарыстоўваючы даныя малюнкаў 103 і 106, растлумачце, якія металы можна прымяніць:
- а) для рэзкі алюмінію, магнію, волава, натрыю;
- б) у якасці электраправодкі або для вырабу электрычных кантактаў.
7. Выключыце лішняе і абгрунтуйце свой выбар:
- а) 1s22s22p5;
- б) 1s22s22p63s23p4;
- в) 1s22s22p63s23p1;
- г) 1s22s22p5.
8. Манета масай 3,9 г мае аб’ём 0,5 см3. З якога металу (сплаву) яна выраблена? Для адказу скарыстайцеся данымі табліцы.
| Металы (сплавы) | Шчыльнасць, г/см3 | Металы (сплавы) | Шчыльнасць, г/см3 |
| Алюміній | 2,7 | Медзь | 8,96 |
| Сталь | 7,6–7,9 | Серабро | 10,5 |
| Бронза | 8,7–9,0 | Золата | 19,3 |
| Нікель | 8,9 | Плаціна | 21,5 |
9. Магній — адзін з найважнейшых біягенных элементаў. Яго ўтрыманне ў арганізме чалавека складае каля 0,05 %. Вызначце масу магнію і лік яго атамаў у арганізме чалавека масай 60 кг.
10. Вызначце метал, масавая доля якога ў яго аксідзе саставу Ме2О3 роўная 68,42 %.
*Самакантроль
1. У зямной кары існуюць толькі ў выглядзе злучэнняў:
- а) Ag;
- б) Cu;
- в) Na;
- г) Zn.
2. Найбольш характэрнымі ўласцівасцямі металаў лічаць:
- а) крохкасць;
- б) пластычнасць;
- в) высокую электраправоднасць;
- г) металічны бляск.
3. Лік металаў большы за лік неметалаў у групе, калі электронная канфігурацыя атамаў элементаў у ёй:
- а) ns1;
- б) ns2nр1;
- в) ns2nр3;
- г) ns2.
4. Правільнымі з’яўляюцца сцвярджэнні:
- а) бронза і латунь — сплавы на аснове медзі;
- б) цвёрдасць сплаваў звычайна вышэйшая, чым цвёрдасць чыстых металаў, якія ўтвараюць іх;
- в) сплавы заўсёды маюць больш высокія тэмпературы плаўлення, чым металы, якія ўтвараюць іх;
- г) утрыманне вугляроду ў сталі вышэйшае, чым у чыгунах.
5. Масавая доля цынку ў латуні — 45 %. Для атрымання 20 кг латуні без прымесей патрабуецца:
- а) 9 кг Zn;
- б) 11 кг Fe;
- в) 9 кг Sn;
- г) 11 кг Cu.