§ 40. Найважнейшыя мінеральныя ўгнаенні
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 40. Найважнейшыя мінеральныя ўгнаенні |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 23:27 |
Угнаенні — рэчывы, што ўносяцца ў глебу ці іншае пажыўнае асяроддзе для вырошчвання раслін. Яны забяспечваюць паўнавартаснае жыўленне раслін, а значыць, паляпшаюць іх рост, развіццё, плоданашэнне і павялічваюць ураджайнасць сельскагаспадарчых культур.
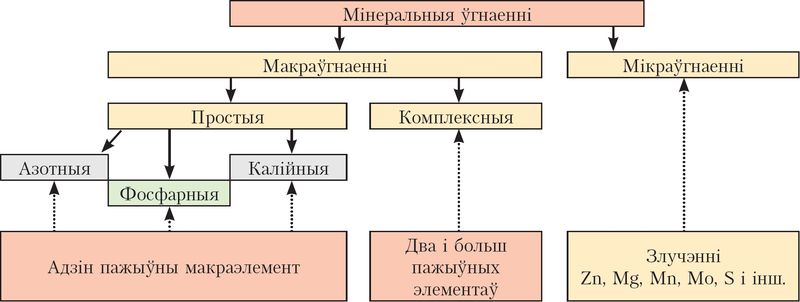
Угнаенні ўтрымліваюць хімічныя элементы, якія неабходны для жыўлення раслін, але прысутнічаюць у асяроддзі іх пражывання ў недастатковых колькасцях. Часцей за ўсё расліны адчуваюць недахоп такіх біялагічна значных элементаў, як азот, калій і фосфар. Па колькасці пажыўных элементаў сярод угнаенняў вылучаюць простыя і комплексныя. Простыя ўгнаенні — азотныя, фосфарныя, калійныя — утрымліваюць адзін пажыўны элемент. У саставе комплексных угнаенняў іх некалькі, напрыклад калійная салетра KNO3 утрымлівае і азот, і калій.
Назіранні паказваюць, што нават пры аптымальнай колькасці і суадносінах азоту, фосфару і калію не заўсёды забяспечваецца нармальнае развіццё раслін. Высвятляецца, што важная таксама наяўнасць у дастатковай меры рэчываў, якія ўтрымліваюць магній, марганец, жалеза, малібдэн, медзь, бор, серу, селен і іншыя. Іх недахоп папаўняецца ўнясеннем мікраўгнаенняў, якія змяшчаюць пералічаныя элементы (мал. 97).
Урадлівасць глеб павялічваюць не толькі пералічаныя вышэй «прамыя» ўгнаенні. Так, урадлівасць кіслых глеб (рН < 5,5) павышаюць, зніжаючы кіслотнасць унясеннем вапны Са(ОН)2 (вапнаваннем), мелу СаСО3 або даламітавай мукі СаMg(CO3)2. Паспрабуйце растлумачыць, чаму пры гэтым кіслотнасць памяншаецца.
У працэсе вывучэння элементаў VA-групы мы пастаянна звярталі ўвагу на ўжыванне многіх іх злучэнняў у якасці ўгнаенняў. Сістэматызуем звесткі пра ўгнаенні і дапоўнім кароткімі звесткамі з курсу біялогіі.
Азотныя ўгнаенні
Першая прыкмета дэфіцыту азоту — колер лісця ад бледна-зялёнага да жоўтага, што тлумачыцца недахопам хларафілу. Расліны моцна адстаюць у росце і развіцці.
Да азотных угнаенняў адносяцца: аміячная вада, нітрат амонію (аміячная салетра) NH4NO3, нітрат калію (калійная салетра) KNO3, нітрат натрыю (натрыевая, або чылійская, салетра) NaNO3, нітрат кальцыю (кальцыевая салетра) Ca(NO3)2, сульфат амонію (NH4)2SO4, мачавіна (карбамід) (NH2)2CO.
Таксама шырока выкарыстоўваюцца арганічныя азотныя ўгнаенні: гной, птушыны памёт, кампост, торф, якія ўтрымліваюць акрамя азоту мноства іншых важных для раслін кампанентаў.
Азотныя ўгнаенні ўносяць у першай палове вегетацыйнага перыяду.
Расліны здольныя назапашваць нітраты. Іх празмернае назапашванне правакуецца не толькі лішкам унесеных азотных угнаенняў, але і незбалансаванасцю з фосфарам і каліем.
Лішак нітратаў у прадуктах харчавання адмоўна адбіваецца на здароўі: нітраты як у прадуктах харчавання, так і ў арганізме чалавека ператвараюцца ў таксічныя нітрыты і нітразаміны.
Вытворцам азотных угнаенняў у Рэспубліцы Беларусь з’яўляецца ААТ «Гродна Азот». У якасці ўгнаенняў аб’яднанне выпускае мачавіну, сульфат амонію і вадкія азотныя ўгнаенні. Большасць цвёрдых азотных угнаенняў выпускаецца ў грануляваным выглядзе, што перашкаджае злежвальнасці дзякуючы памяншэнню паверхні, якая паглынае атмасферную вільгаць.
Фосфарныя ўгнаенні
Пры недахопе фосфару лісце становіцца цёмным, з сіне-фіялетавым адценнем, запавольваецца цвіценне і развіццё пладоў. Расліны могуць засвойваць пажыўныя элементы толькі ў растваральнай форме. Менавіта таму прыродныя мінералы, якія ўтрымліваюць фасфат кальцыю, перапрацоўваюць у больш растваральную кіслую соль — дыгідрафасфат кальцыю. Ён з’яўляецца асновай простага і двайнога суперфасфатаў.
Тым не менш і сярэдняя соль — фасфат кальцыю ў саставе фасфарытнай мукі ўсё ж знаходзіць прымяненне ў якасці ўгнаення. Яе ўносяць на кіслых глебах, або «пад зіму», або ранняй вясной да пасеву. Фасфарытная мука не гіграскапічная, не злежваецца, добра ўтрымліваецца ў глебе, і таму яе можна ўносіць раз на некалькі гадоў. Прывабным бокам з’яўляецца таксама адносна невысокі кошт, бо ў вытворчасці не выкарыстоўваюцца хімічныя ператварэнні. Здабыты ў кар’ерах мінерал толькі ўзбагачаюць (выдаляюць частку прымесей) і тонка здрабняюць.
Да найважнейшых фосфарных угнаенняў адносяцца: фасфарытная мука — асноўны кампанент Ca3(PO4)2, двайны суперфасфат Ca(H2PO4)2 · H2O, просты суперфасфат Ca(H2PO4)2 + 2CaSO4 · H2O, прэцыпітат CaHPO4 ∙ 2H2O.
Комплексныя ўгнаенні, якія ўтрымліваюць фосфар, — гэта амафос — сумесь дзвюх солей NH4H2PO4 і (NH4)2HPO4, якая змяшчае азот і фосфар; амафоска — сумесь амафосу з хларыдам калію — NH4H2PO4, (NH4)2HPO4, KCl, якая ўтрымлівае азот, фосфар і калій.
Фосфарныя ўгнаенні ў Рэспубліцы Беларусь вырабляе ААТ «Гомельскі хімічны завод» на аснове імпартаваных фасфатаў.
Калійныя ўгнаенні
Пры недахопе калію лісце цьмянае і блакітна-зялёнае, на кончыках і краях становіцца бурым і адмірае («краёвы апёк лісця»).
Калій стымулюе працэсы фотасінтэзу, узмацняе адток вугляводаў з лісця ў іншыя часткі расліны, напрыклад спрыяе назапашванню крухмалу ў клубнях бульбы, цукрозы ў караняплодах буракоў. Усе калійныя ўгнаенні добра растваральныя. Падкормка калійнымі ўгнаеннямі важная ў перыяд фарміравання завязяў і караняплодаў. Найважнейшыя калійныя ўгнаенні: хларыд калію KCl, сульфат калію K2SO4, попел раслін (у выглядзе карбанату калію — паташ K2CO3).
Нітрат калію (калійная салетра) KNО3 — комплекснае ўгнаенне, паколькі змяшчае два пажыўныя элементы — калій і азот.
Беларусь — найбуйнейшы вытворца калійных угнаенняў.
Кожная шостая тона калійных угнаенняў у свеце выпускаецца РУП ВА «Беларуськалій», што працуе на базе Старобінскага радовішча сільвініту, радовішча калійнай і каменнай солей.
Пажыўная каштоўнасць мінеральных угнаенняў
На таварных упакоўках фасаваных угнаенняў у абавязковым парадку ўказваецца пажыўная каштоўнасць угнаенняў. Што ж гэта такое?
Пажыўная каштоўнасць вызначаецца масавай доляй пажыўных элементаў у іх. Умоўна прынята выяўляць пажыўную каштоўнасць азотных угнаенняў як масавую долю ў іх хімічнага элемента азоту N, фосфарных — як масавую долю аксіду фосфару(V) Р2О5, калійных — праз масавую долю аксіду калію K2О. Рашым простую задачу.
Прыклад. Вызначце тэарэтычную пажыўную каштоўнасць прэцыпітату.
Дадзена:
CaHPO4 · 2H2O
ω(Р2О5) — ?
Рашэнне
М(CaHPO4 · 2H2O) = 172 г/моль;
М(Р2О5) = 142 г/моль.
Пажыўная каштоўнасць прэцыпітату, як і любога іншага фосфарнага ўгнаення, вызначаецца масавай доляй аксіду фосфару(V) Р2О5. Складзём схему, расстаўляючы каэфіцыенты адносна фосфару:
Схема паказвае, што ўгнаенню колькасцю 2 моль адпавядае 1 моль пажыўнога элемента у выглядзе Р2О5.
m(CaHPO4 · 2H2O) = 2 моль ∙ 172 г/моль = 344 г;
m(Р2О5) = 1 моль ∙ 142 г/моль = 142 г.
Знойдзем масавую долю пажыўнога элемента:
Адказ: ω(Р2О5) = 41,3 %.
Варта адзначыць, што пажыўная каштоўнасць вызначаецца ў кожнай канкрэтнай таварнай партыі ўгнаенняў з улікам прымесей. Гэта азначае, што знойдзенае намі ў прыкладзе тэарэтычнае значэнне вышэйшае, чым у рэальнага ўгнаення. Так, для таварнага прэцыпітату пажыўная каштоўнасць не павінна быць ніжэйшай за 27 % (параўнайце з разлічанай тэарэтычна).
Аналагічныя (ці іншыя) схемы і тэарэтычныя разлікі можна выкарыстоўваць для калійных і азотных угнаенняў, напрыклад:
Угнаенні з высокім утрыманнем пажыўнага элемента называюцца канцэнтраванымі. Выкарыстанне ўсіх відаў угнаенняў дазваляе значна павялічыць ураджаі сельскагаспадарчых культур, таму вытворчасць мінеральных угнаенняў — найважнейшая задача хімічнай прамысловасці. Пры гэтым выкарыстанне ўгнаенняў павінна быць граматным і рацыянальным.
Угнаенні — рэчывы, што ўносяцца ў глебу ці іншае пажыўнае асяроддзе для паляпшэння росту, развіцця і плоданашэння раслін. Сярод мінеральных угнаенняў вылучаюць простыя (азотныя, фосфарныя, калійныя), комплексныя і мікраўгнаенні. Комплексныя ўгнаенні ўтрымліваюць два, тры і больш пажыўных элементаў.
Пытанні, заданні, задачы
1. Запішыце хімічныя формулы і назвы найважнейшых фосфарных, калійных і азотных угнаенняў.
2. Пералічыце прадпрыемствы па выпуску ўгнаенняў у Рэспубліцы Беларусь, іх месцазнаходжанне і віды ўгнаенняў, што выпускаюцца.
3. Назавіце прыкметы, якія сведчаць пра недахоп у жыўленні раслін:
- а) азоту;
- б) фосфару;
- в) калію.
4. Агуркі і памідоры дрэнна пераносяць лішак хлору ў глебе. Назавіце ўгнаенні, прыдатныя для падкормкі гэтых культур каліем.
5. Параўнайце пажыўную каштоўнасць двух угнаенняў:
- а) аміячнай салетры і мачавіны;
- б) хларыду калію і паташу.
6. Разлічыце пажыўную каштоўнасць аднаго з кампанентаў комплекснага ўгнаення амафосу — дыгідрафасфату амонію.
7. Клубеньчыкавыя бактэрыі, якія жывуць у зямлі ў сімбіёзе з бабовымі раслінамі, за год назапашваюць у глебе да 400 кг/га звязанага азоту. Разлічыце масу аміячнай салетры, якую можа кампенсаваць назапашаны такім чынам азот на плошчы 1 га за адзін год.
8. Фосфарныя ўгнаенні атрымліваюць перапрацоўкай фасфарытаў. Найбольш распаўсюджаныя прымесі ў іх фтарыд і карбанат кальцыю, аксіды алюмінію і жалеза(III). Складзіце ўраўненні магчымых рэакцый, якія могуць працякаць пры апрацоўцы такога фасфарыту сернай кіслатой.
9. Адзін са спосабаў атрымання кальцыевай салетры складаецца ў апрацоўцы вапняку азотнай кіслатой. Разлічыце масу нітрату кальцыю, атрыманага пры апрацоўцы азотнай кіслатой вапняку масай 50 кг з масавай доляй прымесей 6 %.
10. Вызначце хімічную формулу ўгнаення, у якім масавая доля кальцыю — 23,256 %, фосфару — 18,023 %, кіслароду — 55,814 %.
*Правядзіце пасяджэнне дыскусійнага клуба «За і супраць»
1. Экалагічныя праблемы вытворчасці мінеральных угнаенняў.
2. Ужыванне мінеральных угнаенняў: плюсы і мінусы.
*Самакантроль
1. У якасці калійных угнаенняў выкарыстоўваюць:
- а) K2CO3;
- б) СаСО3;
- в) KCl;
- г) K2SO4.
2. Комплекснымі ўгнаеннямі з’яўляюцца:
- а) калійная салетра;
- б) амафос;
- в) двайны суперфасфат;
- г) паташ.
3. ААТ «Гродна Азот» у якасці ўгнаенняў выпускае:
- а) NH4NO3;
- б) HNO3;
- в) KCl;
- г) (NH2)2CO.
4. Кіслотнасць глебы паніжаюць унясеннем:
- а) хларыду калію;
- б) аміячнай салетры;
- в) мелу;
- г) даламіту.
5. Масавая доля азоту як пажыўнага элемента ў карбаміду роўная (%):
- а) 21;
- б) 23;
- в) 46;
- г) 47.