§ 37.1. Аксіды азоту(II) і (IV)
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 37.1. Аксіды азоту(II) і (IV) |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 12:16 |
Азот утварае з кіслародам рад аксідаў: ,
,
,
,
. Два з гэтых аксідаў — N2O, NO — адносяцца да нясолеўтваральных, астатнія — да кіслотных.
Аксід азоту(II). Атрыманне і хімічныя ўласцівасці
Аксід азоту(II) NO у звычайных умовах уяўляе сабой бясколерны газ (Tкіп. −151,7 °С, Tпл. −163,7 °С).
У прыродзе ён утвараецца ў выніку ўзаемадзеяння простых рэчываў пры навальнічных разрадах (каля 3000 °С):
N2 + O2 2NO – Q,
у прамысловасці — як прамежкавы прадукт ператварэння аміяку ў азотную кіслату:
4NH3 + 5O2 4NО + 6H2O.
У лабараторыі яго атрымліваюць уздзеяннем разбаўленай азотнай кіслаты на медзь:
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O.
Аксід азоту(II) утвараецца пры працы рухавікоў унутранага згарання з азоту і кіслароду пад дзеяннем высокай тэмпературы і ціску.
Аксід азоту(II) не рэагуе ні з кіслотамі, ні са шчолачамі. Аднак лёгка ўступае ў акісляльна-аднаўленчыя рэакцыі. Так, аксід азоту(II) хутка акісляецца кіслародам з утварэннем аксіду азоту(IV):
.
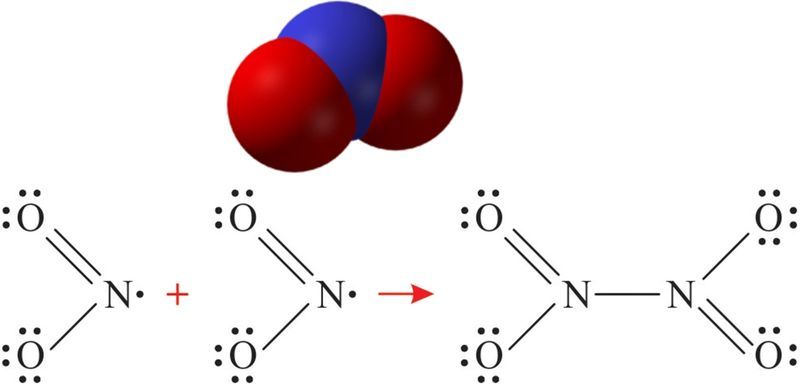
Аксід азоту(IV). Атрыманне і хімічныя ўласцівасці
Малекула NO2 мае вуглавую форму (мал. 94.1). Мяркуецца, што атам азоту знаходзіцца ў стане sp2-гібрыдызацыі, даўжыня сувязі N—O роўная 0,119 нм, што адпавядае паўтарачнай сувязі.
Аксід азоту(IV) NO2, дыаксід азоту — газ бурага колеру (Тпл. −11,2 °С, Tкіп. 21 °С), у вадкім і цвёрдым стане бясколерны і складаецца з малекул N2O4 у выніку дымерызацыі:
2NO2 N2O4 + Q.
Дымерызацыя лёгка адбываецца з-за наяўнасці няспаранага электрона. У газападобным стане аксід азоту(IV) дымерызаваны часткова.
У лабараторыі звычайна яго атрымліваюць вядомай вам рэакцыяй канцэнтраванай азотнай кіслаты з меддзю:
Cu + 4HNO3(канц) = Cu(NO3)2 + 2NO2↑ + 2H2O
або раскладаннем некаторых нітратаў (§ 38).
Аксід азоту(IV) узаемадзейнічае з вадой. У залежнасці ад умоваў утвараюцца розныя прадукты. Так, пры пакаёвай тэмпературы ўтвараюцца азотная і азоцістая кіслоты:
.
Пры растварэнні NO2 у вадзе пры павышанай тэмпературы ў лішку кіслароду ўтвараецца азотная кіслата:
.
Раўнавагу гэтай абарачальнай рэакцыі пры прамысловым атрыманні азотнай кіслаты зрушваюць управа, павялічваючы ціск.
Пры растварэнні NO2 у шчолачах утвараюцца нітраты разам з нітрытамі:
Недастатковая ачыстка газаў, што вылучаюцца ў навакольнае асяроддзе прадпрыемствамі, якія вырабляюць азотную кіслату, катламі электрастанцый, газатурбіннымі ўстаноўкамі, рухавікамі аўтамабіляў і самалётаў, прыводзіць да забруджвання атмасферы аксідамі азоту. Пад дзеяннем кіслароду NO ператвараецца ў NO2. У вільготнай атмасферы ўтвараецца азотная кіслата, і на зямлю выпадаюць кіслотныя дажджы, шкодныя не толькі для чалавека і жывёл, але і для раслін. Пад дзеяннем кіслотных дажджоў разбураюцца збудаванні.
Газападобны аксід азоту(I) N2O пры ўдыханні прыводзіць да зніжэння болевай адчувальнасці, таму яго часам ужываюць у сумесі з кіслародам для наркозу.
Аксід N2O3 устойлівы толькі пры нізкіх тэмпературах (Тпл. −102 °С, Ткіп. 4 °С, Траскл. 4,5 °С) і ўяўляе сабой вадкасць блакітнага колеру. Пры ўзаемадзеянні з вадой утварае азоцістую кіслату:
.
Аксід азоту(V) N2O5 — цвёрдае рэчыва белага колеру. Рэагуючы з вадой, утварае азотную кіслату:
.
Аксід азоту(II) — нясолеўтваральны аксід. Пры ўзаемадзеянні з кіслародам ператвараецца ў аксід азоту(IV).
Аксід азоту(IV) праяўляе акісляльныя ўласцівасці; пры растварэнні ў вадзе ў прысутнасці кіслароду ўтварае азотную кіслату.
Пытанні, заданні, задачы
1. Выпішыце формулы солеўтваральных аксідаў: N2O5, NO2, N2O3, NO, N2O.
2. Запішыце формулы аксідаў, якія адпавядаюць кіслотам HNO2 і HNO3.
3. Якія з аксідаў азоту можна збіраць метадам выцяснення вады?
4. Якія з аксідаў азоту могуць рэагаваць са шчолачамі? Запішыце формулы гэтых аксідаў.
5. Запішыце ўраўненні рэакцый, адпаведных узаемадзеянню аксіду азоту(IV) з вадой у розных умовах.
6. Вызначце суму электронаў у малекуле:
- а) аксіду азоту(II);
- б) аксіду азоту(IV).
7. Укажыце, у які бок зрушыцца раўнавага ў рэакцыі: 2NO2(г) N2O4(г) + Q:
а) пры павелічэнні ціску;
б) пры паніжэнні тэмпературы.
Як зменіцца афарбоўка рэакцыйнай сумесі ў кожным з выпадкаў?
8. Расстаўце каэфіцыенты метадам электроннага балансу:
NaOH + O2 + NO2 = NaNO3 + H2O.
9. Складзіце ўраўненні рэакцый паводле схемы:
.
10. Вызначце масавую долю (%) солі, якая ўтварылася ў растворы пры прапусканні аксіду азоту(IV) аб’ёмам 1,12 дм3 (н. у.) у сумесі з лішкам кіслароду праз раствор гідраксіду кальцыю масай 300 г з масавай доляй шчолачы 0,166 %.
Самакантроль
1. Нясолеўтваральнымі аксідамі з’яўляюцца:
- а) NO;
- б) N2O5;
- в) N2O3;
- г) N2O.
2. Як акісляльнікам, так і адноўнікам у хімічных рэакцыях могуць быць:
- а) NН3;
- б) NO;
- в) N2O3;
- г) N2O5.
3. Прадуктамі ўзаемадзеяння NO2 з вадой могуць быць:
- а) HNO3;
- б) HNO2;
- в) NO;
- г) N2O5.
4. Аксід азоту NO2 утварае солі, рэагуючы з:
- а) вадой;
- б) гідраксідам барыю;
- в) гідраксідам кальцыю;
- г) вуглевадародамі.
5. Аб’ём газу (н. у.), атрыманага ў рэакцыі медзі масай 3,2 г з канцэнтраванай азотнай кіслатой пры выхадзе прадукту 85 %, роўны:
- а) 1,9 дм3;
- б) 2,24 дм3;
- в) 2,56 дм3;
- г) 2,64 дм3.