§ 35. Серная кіслата
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 35. Серная кіслата |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 19:35 |
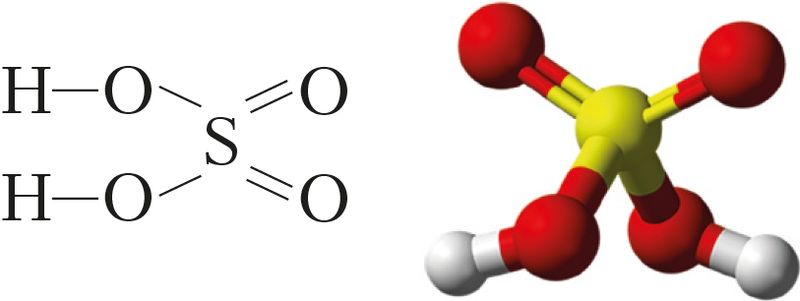
Серная кіслата Н2SO4 — найважнейшая з мінеральных кіслот.
Гэта рэчыва малекулярнай будовы. Са структурнай формулы відаць, што серная кіслата з’яўляецца гідраксідам і адносіцца да двухасноўных кіслот (мал. 83).
Прамысловае атрыманне сернай кіслаты — многастадыйны працэс, сыравіна для яго — гэта пірыт (жалезны або серны калчадан) FeS2 і іншыя сульфідныя руды, сера S, серавадарод H2S (з нафты), адкіды металургічнай вытворчасці. Схема атрымання кіслаты з пірыту выглядае так:
Як відаць, працэс уключае тры стадыі, якія паказваюцца наступнымі ўраўненнямі рэакцый:
На трэцяй стадыі аксід серы(VI) SO3 у паглынальнай вежы арашаецца канцэнтраванай сернай кіслатой з масавай доляй кіслаты 96–98 % (гэта значыць утрыманне вады ўсяго 2–4 %). Пры гэтым атрымліваюць раствор аксіду серы(VI) у сернай кіслаце (олеум). Ваду для паглынання SO3 не выкарыстоўваюць, бо з-за вылучэння вялікай колькасці цеплаты ўтвараецца «сернакіслотны туман», які цяжка скандэнсаваць.
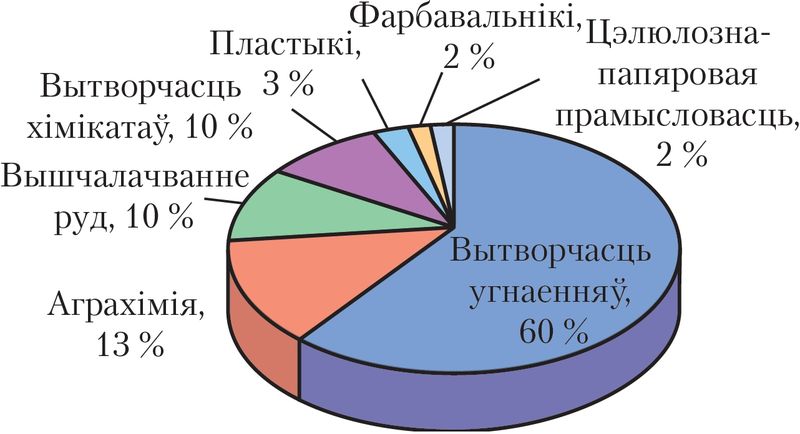
Сусветная вытворчасць сернай кіслаты — каля 200 млн тон за год. Самы буйны спажывец сернай кіслаты — вытворчасць мінеральных угнаенняў. Акрамя таго, яна выкарыстоўваецца для атрымання розных мінеральных кіслот і солей, хімічных валокнаў, фарбавальнікаў, выбуховых рэчываў, у прамысловым арганічным сінтэзе, у нафтавай, металаапрацоўчай, тэкстыльнай, гарбарнай, харчовай і іншых галінах прамысловасці (мал. 84), як электраліт у свінцовых акумулятарах (мал. 85).

Фізічныя ўласцівасці
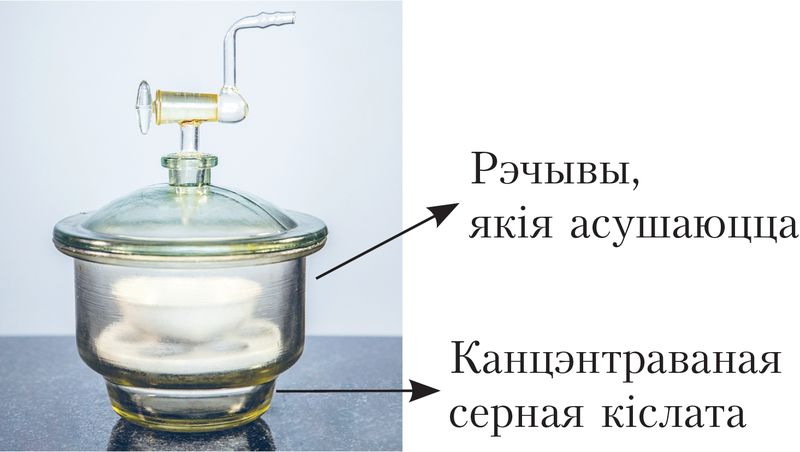
Серная кіслата — цяжкая бясколерная алеістая вадкасць, з тэмпературай плаўлення 10,4 °С, шчыльнасцю 1,84 г/см3. Яна змешваецца з вадой у любых суадносінах. Пры растварэнні кіслаты ў вадзе вылучаецца значная колькасць цеплаты, што з’яўляецца сведчаннем утварэння трывалых гідратаў. З гэтай прычыны серная кіслата — моцны водаадымальны сродак, яе выкарыстоўваюць для асушэння розных рэчываў, у тым ліку і газаў (мал. 86).
Важна памятаць: пры разбаўленні кіслату павольна льюць у ваду, каб цяжкія струменьчыкі кіслаты апускаліся на дно пасудзіны. Гэта неабходна для прадухілення распырсквання вадкасці ў выніку моцнага павышэння тэмпературы.
Пры кантакце са скурай серная кіслата выклікае цяжкія апёкі, яе пары шкодзяць слізістым абалонкам і лёгкім.
Хімічныя ўласцівасці
Уласцівасці разбаўленай і канцэнтраванай сернай кіслот істотна адрозніваюцца.
Хімічныя ўласцівасці разбаўленай сернай кіслаты. Разбаўленая серная кіслата — моцны электраліт, яна праяўляе агульныя ўласцівасці кіслот: змяняе колер індыкатараў і ўтварае солі ў рэакцыях з металамі, асноўнымі і амфатэрнымі аксідамі, гідраксідамі металаў, іншымі солямі. Разгледзім канкрэтныя прыклады.
1. Індыкатары лакмус і метыларанж афарбоўваюць раствор сернай кіслаты ў чырвоны колер. У разбаўленых растворах серная кіслата дысацыіруе паводле схемы:
2. Утварэнне солей:
а) металы, размешчаныя ў радзе актыўнасці да вадароду, выцясняюць яго з разбаўленых раствораў сернай кіслаты:
Zn + Н2SO4 = ZnSO4 + H2↑;
Fe + Н2SO4 = FeSO4 + H2↑;
б) рэакцыі сернай кіслаты з асноўнымі і амфатэрнымі аксідамі, як правіла, патрабуюць невялікага награвання для павелічэння скорасці:
СuO + Н2SO4 = CuSO4 + H2O;
Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в) у рэакцыях са шчолачамі і нерастваральнымі асновамі ўтвараюцца солі і вада (нейтралізацыя):
2NaOH + Н2SO4 = Na2SO4 + 2H2O або NaOH + Н2SO4 = NaНSO4 + H2O;
Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Адзначым, што пры мольных суадносінах шчолачы NaOH і кіслаты Н2SO4 2 : 1 або лішку NaOH утвараецца сярэдняя соль (сульфат), а пры іх суадносінах 1 : 1 — кіслая соль (гідрасульфат). Такім чынам, лішак шматасноўнай (двухасноўнай) кіслаты Н2SO4 прыводзіць да ўтварэння кіслых солей;
г) рэакцыі раствораў сернай кіслаты з солямі працякаюць у поўнай адпаведнасці з умовамі рэакцый іоннага абмену:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓.
Хімічныя ўласцівасці канцэнтраванай сернай кіслаты. У моцна канцэнтраваных растворах дысацыяцыя сернай кіслаты працякае толькі па першай ступені: . Канцэнтраваная серная кіслата — больш моцны акісляльнік, чым разбаўленая. Яе акісляльныя ўласцівасці выяўляюцца перш за ўсё ў рэакцыях з металамі. Адзначым некалькі важных момантаў.
Па-першае, адбываецца аднаўленне не вадароду, а атамаў серы. Прадуктамі аднаўлення з’яўляюцца SO2, S і Н2S. Састаў пераважна ўтвораных прадуктаў залежыць як ад канцэнтрацыі кіслаты, так і ад актыўнасці металу як адноўніку. Чым меншая канцэнтрацыя кіслаты і вышэйшая актыўнасць металу, тым мацней аднаўляюцца атамы серы. У агульным выглядзе ўзаемадзеянне канцэнтраванай сернай кіслаты з металамі можна паказаць схемай:

Так, у рэакцыі з металамі, якія знаходзяцца ў радзе актыўнасці пасля вадароду (акрамя золата і плаціны), утвараецца аксід серы(IV) SO2, напрыклад:
У рэакцыях з металамі, размешчанымі ў радзе актыўнасці да вадароду, могуць утварацца і SO2, і S, і Н2S. Напрыклад, схемы рэакцый, якія праходзяць пры ўзаемадзеянні цынку з сернай кіслатой з павелічэннем яе канцэнтрацыі, выглядаюць так:
Па-другое, некаторыя параўнальна актыўныя металы (напрыклад, жалеза, алюміній, хром) канцэнтраванай сернай кіслатой пры пакаёвай тэмпературы пасівіруюцца: на паверхні металу ўтвараецца шчыльная аксідная плёнка. Дзякуючы пасівацыі жалеза магчыма перавозка кіслаты ў сталёвых цыстэрнах.
Сярод іншых асаблівасцей канцэнтраванай сернай кіслаты можна адзначыць наступныя. Яна здольна выцясняць менш моцныя ці больш лятучыя кіслоты (НСl, HNO3, H3PO4, CH3COOH) з іх солей:
Канцэнтраваная кіслата акісляе складаныя арганічныя рэчывы: апальвае паперу, драўніну, скуру, таму з ёй трэба абыходзіцца вельмі асцярожна.
З-за асаблівасці канцэнтраванай сернай кіслаты ўтвараць гідраты H2SO4 · nH2O яе шырока выкарыстоўваюць як моцны водаадымальны сродак, а таксама як каталізатар у арганічным сінтэзе.
Прымяненне канцэнтраванай сернай кіслаты як водаадымальнага сродку і каталізатару ў арганічным сінтэзе дэманструюць ураўненні рэакцый:
Сульфаты: фізічныя і хімічныя ўласцівасці, прымяненне
Серная кіслата, як было адзначана вышэй, утварае два рады солей — гідрасульфаты (кіслыя) і сульфаты (сярэднія), большасць з якіх добра растваральныя. У цвёрдым выглядзе з кіслых солей вылучаны солі толькі актыўных металаў (KНSO4, NaHSO4 і інш.). Сярэднія солі часта ўтвараюць крышталагідраты (Na2SO4 ∙ 10H2O, CuSO4 ∙ 5H2O і інш.), таму бязводныя солі (сульфат натрыю, сульфат магнію) выкарыстоўваюць у лабараторнай практыцы ў якасці асушальнікаў. Сульфаты шчолачных металаў маюць дастаткова высокую тэрмічную ўстойлівасць.
Для ідэнтыфікацыі (якаснага выяўлення) сульфат-іонаў часцей за ўсё выкарыстоўваюць растваральныя солі барыю (ВаСl2 або Ва(NO3)2). Пры гэтым утвараецца белы асадак сульфату барыю (Дадатак 3):
Многія сульфаты з’яўляюцца рэчывамі буйнатанажнай вытворчасці (табл. 28).
Табліца 28. Прымяненне сульфатаў
| Хімічная формула і назва | Сферы выкарыстання | |
Na2SO4 · 10H2O глаўберава соль (мірабіліт) |
 |
Вытворчасць сінтэтычных мыйных сродкаў, цэлюлозы, шкляная вытворчасць, тэкстыльная прамысловасць |
MgSO4 · 7H2O горкая (англійская) соль |
 |
Медыцына — для паніжэння ціску пры ўнутрывенным увядзенні; слабільны сродак. Мікраўгнаенне. Сушэнне растваральнікаў у лабараторнай практыцы бязводным сульфатам магнію |
CuSO4 · 5H2O медны купарвас |
 |
Медыцына і раслінаводства — антысептык. У саставе бардоскай сумесі як фунгіцыд |
FeSO4 · 7Н2О жалезны купарвас |
 |
Сельская гаспадарка — фунгіцыд, дрэваапрацоўчая прамысловасць — антысептык для насычэння драўніны. Вытворчасць мінеральных фарбаў |
* ZnSO4 · 7Н2О цынкавы купарвас |
 |
Валодае высокім супрацьмікробным і бактэрыцыдным дзеяннем. Выкарыстоўваецца ў медыцыне (мазі, вочныя кроплі і інш.) і аграрным сектары (павышэнне ўраджайнасці, нармалізацыя імуннай сістэмы жывёл) |
Разбаўленая серная кіслата — моцны электраліт, праяўляе агульныя ўласцівасці кіслот. Канцэнтраваная серная кіслата — моцны акісляльнік.
Серная кіслата як двухасноўная ўтварае два рады соляў — гідрасульфаты (кіслыя) і сульфаты (сярэднія).
Пры ўзаемадзеянні разбаўленай сернай кіслаты з металамі ўтвараюцца соль і вадарод, а канцэнтраванай — соль, вада і прадукты аднаўлення серы — SO2, S і Н2S.
Для якаснага выяўлення сульфат-іонаў выкарыстоўваюць растворы хларыду або нітрату барыю.
У аснове прамысловага атрымання сернай кіслаты з пірыту ляжаць рэакцыі, якія ажыццяўляюцца ў адпаведнасці са схемай:
FeS2 → SO2 → SO3 → H2SO4.
Пытанні, заданні, задачы
1. Запішыце малекулярную і структурную формулы сернай кіслаты. Назавіце сферы яе прымянення.
2. З тэксту параграфа выпішыце формулы:
- а) кіслых солей;
- б) крышталегідратаў.
Назавіце іх.
3. Складзіце формулы рэчываў:
- а) сульфат барыю, гідрасульфат літыю, сульфат жалеза(II), сульфат жалеза(III);
- б) сульфат магнію, сульфат алюмінію, гідрасульфат барыю, сульфат серабра(I).
4. З пераліку Mg, Zn, Al, Ag, Fe, Cr, Sn, Cu, Au, Рt выпішыце сімвалы металаў, якія:
- а) не выцясняюць вадарод з раствору сернай кіслаты;
- б) пасівіруюцца канцэнтраванай сернай кіслатой.
5. Складзіце ўраўненні рэакцый утварэння кіслых і сярэдніх солей пры ўзаемадзеянні гідраксідаў натрыю і кальцыю:
- а) з сернай кіслатой;
- б) сярністай кіслатой;
- в) аксідам серы(IV). Назавіце ўтвораныя солі.
6. Аксід серы(VI) масай 8 г растварылі ў вадзе масай 132 г. Вызначце масавую долю кіслаты ў растворы.
7. Расстаўце каэфіцыенты метадам электроннага балансу ва ўраўненнях рэакцый, якія праходзяць пры ўзаемадзеянні цынку з канцэнтраванай сернай кіслатой рознай канцэнтрацыі, згодна са схемамі на с. 193, 194.
8. Другая стадыя вытворчасці сернай кіслаты з пірыту — акісленне аксіду серы(IV) у аксід серы(VI) — заснавана на абарачальнай каталітычнай рэакцыі:
Ва ўмовах вытворчасці SO3 з’яўляецца газам. Пакажыце ўмовы зрушвання раўнавагі ў бок прадукту рэакцыі.
9. Вызначце масу раствору сернай кіслаты з масавай доляй 20 %, які можна атрымаць пры разбаўленні раствору аб’ёмам 1 дм3 (шчыльнасць 1,835 г/см3) з масавай доляй сернай кіслаты 96 %.
10. Ёсць 500 г раствору аксіду серы(VI) у сернай кіслаце. Масавыя долі H2SO4 і SO3 складаюць 92 % і 8 % адпаведна. Колькі грамаў вады трэба дадаць для атрымання 100%-най сернай кіслаты?
*Самакантроль
1. Укажыце прыкметы, характэрныя для сернай кіслаты:
- а) моцны электраліт;
- б) кіслародзмяшчальная;
- в) ступень акіслення серы +4;
- г) аднаасноўная.
2. Глаўберава соль мае састаў:
- а) Na2CO3 · 10H2O;
- б) Na2SO4 · 10H2O;
- в) FeSO4 · 7Н2О;
- г) MgSO4 · 7Н2О.
3. Белы асадак выпадае пры ўзаемадзеянні хларыду барыю з воднымі растворамі:
- а) MgSO4;
- б) NaHSO4;
- в) SO3;
- г) Na2S.
4. Працэс абпалу сернага калчадану ілюструе схема:
- а) FeS → SO2;
- б) H2S → SO2;
- в) SO2 → SO3;
- г) FeS2 → SO2.
5. З металам рэагуе канцэнтраваная серная кіслата, калі прадуктамі рэакцыі з’яўляюцца:
- а) … → MgSO4 + Н2О + H2S↑;
- б) … → MgSO4 + Н2О + S↓;
- в) … → Аg2SO4 + Н2О + SO2↑;
- г) … → ZnSO4 + Н2↑.