§ 32.1. Азон
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 32.1. Азон |
| Напечатано:: | Гость |
| Дата: | Среда, 13 Август 2025, 20:09 |
Малекула азону мае вуглавую будову з прычыны sp2-гібрыдызацыі арбіталей цэнтральнага атама кіслароду, вугал сувязі — каля 117°. Будова малекулы азону паказана на малюнку 74.1.
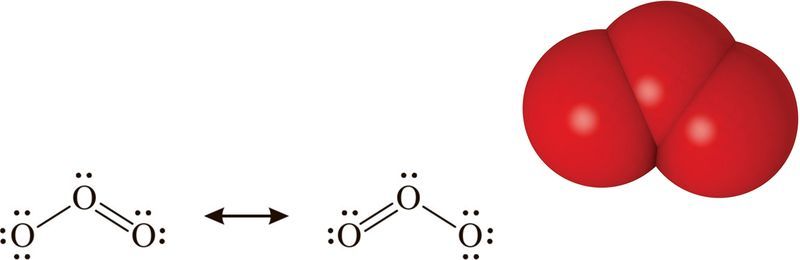
Утварэнне азону ў прыродзе і яго штучны сінтэз
Утварэнне азону з кіслароду — эндатэрмічны працэс:
3О2 2О3 – Q.
У прыродзе азон утвараецца з атмасфернага кіслароду пры навальнічных разрадах, а на вышыні 10–30 км — пад дзеяннем ультрафіялетавага выпраменьвання. Утварэнне азону з малекул кіслароду ў верхніх слаях атмасферы схематычна паказана на малюнку 74.2. Азонавы слой над паверхняй Зямлі затрымлівае шкоднае для жыцця ультрафіялетавае выпраменьванне Сонца і паглынае інфрачырвонае выпраменьванне Зямлі, перашкаджаючы яе пераахаладжэнню. У гэтым найважнейшая роля азону ў жыцці ўсяго жывога на нашай планеце.
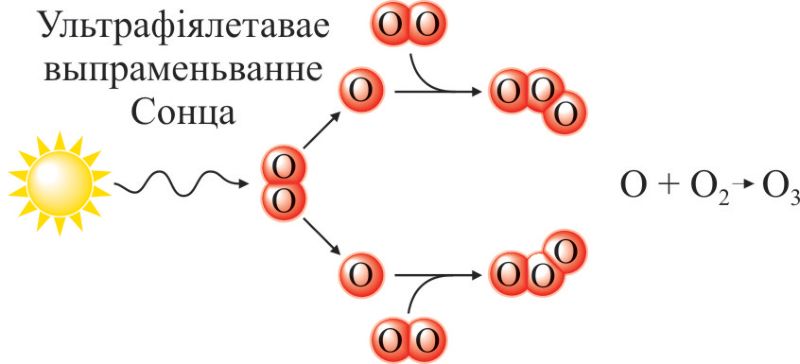
Наяўны азонавы слой разбураецца пад дзеяннем фтараваных і хлараваных вуглевадародаў, аксіду азоту(I) і многіх іншых рэчываў, якія ўваходзяць у састаў холадагентаў, пенаўтваральнікаў, выхлапных газаў, растваральнікаў, шматлікіх хімікатаў.
Азон утвараецца не толькі ў прыродзе, але і падчас працы лазерных прынтараў, капіявальнай тэхнікі, лазерных крыніц, газаразрадных і люмінесцэнтных прылад, штучных крыніц ультрафіялетавага выпраменьвання, напрыклад ртутна-кварцавых лямпаў.
У прамысловасці азон атрымліваюць з паветра або кіслароду пад дзеяннем электрычнага разраду ў спецыяльных прыборах — азанатарах.
Фізічныя ўласцівасці і фізіялагічнае дзеянне
Азон — газ з рэзкім пахам, мае блакітны колер, у вадкім стане — сіні. Шчыльнасць азону пры н. у. у 1,5 разы большая за шчыльнасць кіслароду. Тэмпература кіпення –111,8 °С, што амаль на 70 °С вышэй, чым у кіслароду.
Азон вельмі таксічны. Яго адносяць да першага, самага высокага класа небяспекі. ГДК (гранічна дапушчальная канцэнтрацыя) азону ў паветры працоўнай зоны — 0,1 мг/м3. Характэрны пах азону пачынае адчувацца ўжо пры канцэнтрацыях 0,004–0,010 мг/м3, гэта значыць у шмат разоў ніжэйшых за гігіенічны нарматыў. Гэта важна для персаналу, які працуе з азонам. Прыборы, пры працы якіх генеруецца азон, варта выкарыстоўваць толькі ў памяшканнях з добрай вентыляцыяй.
Таксічнасць азону абумоўлена яго моцнай акісляльнай здольнасцю. Ён раздражняе і пашкоджвае тканкі органаў дыхання. Пры яго ўздзеянні на арганізм у выніку шэрагу рэакцый утвараюцца свабодныя радыкалы кіслароду. Тым не менш менавіта дзякуючы гэтым уласцівасцям азон валодае бактэрыцыдным, супрацьвірусным і супрацьгрыбковым дзеяннем.
Хімічныя ўласцівасці
1. Пры нармальных умовах азон можа павольна самаадвольна ператварацца ў кісларод з вылучэннем цеплаты:
2О3 3О2 + Q.
Працэс паскараецца пад дзеяннем каталізатараў, УФ-апраменьвання. Павышэнне тэмпературы і паніжэнне ціску паскараюць гэты працэс. Азон — больш моцны акісляльнік, чым кісларод, бо ад яго малекулы ў працэсе хімічных рэакцый лёгка адрываецца адзін атам кіслароду:
О3 = О2 + О.
Менавіта атамарны кісларод удзельнічае ў рэакцыях акіслення, а малекулы кіслароду часцей за ўсё з’яўляюцца адным з прадуктаў рэакцый. Напрыклад, азон рэагуе з азотам пры тэмпературы 295 °С:
N2 + O3 = N2O + O2,
у той час як кісларод узаемадзейнічае з азотам пры тэмпературы большай за 3000 °С:
N2 + O2 = 2NO – Q.
2. Азон акісляе ўсе металы (за невялікім выключэннем, напрыклад, золата, плаціны):
.
3. Азон акісляе атамы элементаў у ніжэйшых ступенях акіслення ў саставе аксідаў, гідраксідаў, солей. Напрыклад:
.
4. Азон узаемадзейнічае з растворам ёдыду калію. Нават без награвання азон акісляе ёдыд-іоны, у выніку чаго вылучаецца свабодны ёд:
.
Гэтая рэакцыя з’яўляецца тэстам (якаснай рэакцыяй) на прысутнасць азону. Фільтравальная папера, насычаная сумессю ёдыду калію і крухмалу, сінее ў азоне ў выніку вылучэння ёду.
5. Азон разбурае арганічныя рэчывы: фарбавальнікі страчваюць колеры, спірты, эфіры, шкіпінар запальваюцца, гума «старэе». Малекулы ненасычаных арганічных злучэнняў у рэакцыях з азонам разрываюцца па месцы кратных сувязей.
Выкарыстанне
Азон гібельна дзейнічае на бактэрыі, таму выкарыстоўваецца для абеззаражання памяшканняў і медыцынскага абсталявання.
Азон — вельмі моцны акісляльнік, таму яго ўжываюць для абеззаражання вады. Азанаванне вады, у адрозненне ад яе хларавання, не прыводзіць да ўтварэння хлорарганічных рэчываў, якія таксічныя і з’яўляюцца канцэрагенамі.
Азон утвараецца з кіслароду пры электрычных разрадах і пад дзеяннем ультрафіялетавага выпраменьвання.
Азон таксічны, з’яўляецца моцным акісляльнікам. Ужываецца для абеззаражання памяшканняў, медыцынскага абсталявання і вады.
Пытанні, заданні, задачы
1. Апішыце будову малекулы азону.
2. Якім фізіялагічным дзеяннем валодае азон?
3. Пералічыце фізічныя ўласцівасці азону. Улічваючы тэмпературу плаўлення гэтага рэчыва, прапануйце метад раздзялення кіслароду і азону.
4. У трох закрытых колбах знаходзяцца газы азон, кісларод, хлоравадарод. Прапануйце план іх распазнавання.
5. Разлічыце масу сумесі, якая ўтрымлівае кісларод і азон колькасцю 3 моль і 0,5 моль адпаведна.
6. Як і ў колькі разоў зменіцца аб’ём газу ў выніку поўнага ператварэння газападобнага кіслароду ў азон?
7. Вызначце адносную шчыльнасць па вадародзе сумесі, якая ўтрымлівае кісларод масай 3,2 г і азон колькасцю 0,125 моль.
8. Складзіце ўраўненні рэакцый паводле схемы:
.
9. Адносная шчыльнасць сумесі азону і кіслароду па паветры роўная 1,195. Вызначце аб’ём такой сумесі (н. у.), неабходны для поўнага акіслення метану аб’ёмам 1 дм3.
10. У сумесі кіслароду і азону лік малекул у 2,2 разу меншы за лік атамаў. Разлічыце масу азону ў гэтай сумесі масай 100 г.
Самакантроль
1. Алатропнай мадыфікацыяй кіслароду з’яўляецца:
- а) азот;
- б) азон;
- в) алмаз;
- г) графіт.
2. Правільнымі сцвярджэннямі ў адносінах да азону з’яўляюцца:
- а) малекулы рэчыва трохатамныя;
- б) раскладанне азону — працэс экзатэрмічны;
- в) азон з’яўляецца высокатаксічным рэчывам;
- г) азон валодае высокім акісляльным дзеяннем.
3. Сума каэфіцыентаў ва ўраўненні рэакцыі NaI + H2O + O3 = NaOH + I2 + O2 роўная:
- а) 6;
- б) 8;
- в) 10;
- г) 11.
4. Вільготная ёдкрухмальная папера становіцца сіняй пры кантакце з:
- а) О3;
- б) I2;
- в) KI;
- г) KOH.
5. Сумесь азону і кіслароду можа мець малярную масу (г/моль):
- а) 34,5;
- б) 18;
- в) 29;
- г) 37.