§ 12. Значэнне перыядычнага закону і перыядычнай сістэмы Д. І. Мендзялеева для развіцця навукі
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Падручнік: | § 12. Значэнне перыядычнага закону і перыядычнай сістэмы Д. І. Мендзялеева для развіцця навукі |
| Надрукаваны: | Госць |
| Дата: | Панядзелак 18 Жнівень 2025 |

Перыядычны закон і перыядычная сістэма хімічных элементаў Д. І. Мендзялеева — велізарнае адкрыццё ў гісторыі навукі (мал. 23). Яно вызначыла пачатак новай эпохі ў развіцці хіміі. У хімікаў з’явіўся інструмент, які дазваляе прагназаваць адкрыццё новых элементаў і праводзіць навуковыя даследаванні, накіраваныя на стварэнне новых рэчываў і матэрыялаў.
Н. Бор назваў перыядычную сістэму Мендзялеева «пуцяводнай ніткай у распрацоўцы тэорыі электроннай будовы атама». На падставе перыядычнай сістэмы былі распрацаваны тэорыя хімічнай сувязі, канцэпцыі атамных і іонных радыусаў, электраадмоўнасці і г. д. Структура «натуральнай сістэмы хімічных элементаў», распрацаваная Д. І. Мендзялеевым у 1869–1871 гадах, аказалася настолькі дасканалай, што мала адрозніваецца ад сучаснай. Зразумела, многія адкрыцці ў галіне хіміі і фізікі ўносілі ў яе змяненні, але спраўдзіліся прарочыя словы Д. І. Мендзялеева: «Відаць, перыядычнаму закону будучыня не пагражае разбурэннем, а толькі надбудовы і развіццё абяцае».
Характарыстыка хімічнага элемента па яго становішчы ў перыядычнай сістэме і будове атама
Па становішчы хімічнага элемента ў перыядычнай сістэме можна даць даволі поўную яго характарыстыку. Ключавую ролю адыгрывае атамны (парадкавы) нумар, які вызначае будову атама. Будова электроннай абалонкі атама, у сваю чаргу, вызначае састаў простых і складаных рэчываў, якія ўтвараюцца, і іх уласцівасці.
Вывучаючы хімію ў 8-м класе, вы ўжо складалі характарыстыку хімічнага элемента. У 11-м класе вы будзеце больш шырока выкарыстоўваць набытыя веды пра будову атама і стан электронаў у атаме і апісваць элемент па наступным плане.
1. Становішча ў перыядычнай сістэме (атамны нумар, перыяд, група), адносная атамная маса.
2. Будова атама:
- а) састаў ядра: зарад, лік пратонаў, а таксама нейтронаў для вызначанага нукліду;
- б) будова электроннай абалонкі: агульная колькасць электронаў, лік энергетычных узроўняў, размеркаванне электронаў па энергетычных узроўнях (электронная схема), падузроўнях (формула электроннай канфігурацыі) і арбіталях (электронна-графічная схема);
- в) канфігурацыя знешняга электроннага слоя.
3. Ступені акіслення атама элемента (найвышэйшая, найніжэйшая). Электраадмоўнасць.
4. Простае рэчыва: хімічная формула, уласцівасці простага рэчыва (агрэгатны стан пры н. у., метал ці неметал).
5. Злучэнні элемента: вышэйшы аксід і адпаведны яму гідраксід, характарыстыка іх кіслотна-асноўных уласцівасцей; формула вадароднага злучэння.
Д. І. Мендзялееў на падставе распрацаванай ім сістэмы хімічных элементаў выправіў значэнні атамных мас і валентнасці некаторых элементаў (Ве, In, Mo, Sb, Ce, Te, Y, Th, U і інш.), прадказаў існаванне 10 яшчэ не адкрытых элементаў (Sc, Ga, Ge, Po, At, Tc, Fr, Pa, Hf, Re). Адкрыццё гэтых элементаў пазней стала трыумфам перыядычнага закону.
Варта адзначыць, што, складаючы больш разгорнутую характарыстыку, можна правесці параўнанне электраадмоўнасці, металічных ці неметалічных уласцівасцей простага рэчыва, кіслотна-асноўных уласцівасцей аксідаў і гідраксідаў з аналагічнымі ўласцівасцямі іншых элементаў у групе або перыядзе. Меркаванні пра ўласцівасці рэчываў робяць цалкам дарэчным складанне некаторых ураўненняў рэакцый. Напрыклад, можна пацвердзіць кіслотныя ўласцівасці запісам раўнанняў рэакцый са шчолачамі, асноўныя — з кіслотамі, амфатэрныя — і з кіслотамі, і са шчолачамі. Аднак больш дэталёвыя веды кіслотна-асноўных і акісляльна-аднаўленчых уласцівасцей элементаў вы атрымаеце, вывучаючы раздзелы «Неметалы» і «Металы».
Прыклад 1. Па прыведзеным вышэй плане складзіце характарыстыку элемента азот.
1. Элемент азот мае хімічны знак N, атамны нумар Z = 7. Азот размешчаны ў другім перыядзе, малым, у IIA-групе, галоўнай. Адносная атамная маса Ar(N) = 14.
2. Будова атама азоту:
а) зарад ядра атама азоту +7. У састаў ядра атама азоту ўваходзяць 7 пратонаў. Самы распаўсюджаны ў прыродзе ізатоп азоту — гэта нуклід 14N. Лік нейтронаў у ядры гэтага нукліду роўны 14 – 7 = 7;
б) электронная абалонка атамаў азоту змяшчае 7 электронаў, якія размеркаваны па двух энергетычных узроўнях; электронная схема: 7N 2e–, 5e–;
формула электроннай канфігурацыі: 7N 1s22s22p3;
электронна-графічная схема:
7N 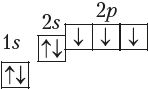
в) канфігурацыя знешняга электроннага слоя: 2s22p3, значыць, азот — p-элемент.
3. Ступені акіслення атамаў элемента: найвышэйшая +5, паколькі на знешнім энергетычным узроўні атама знаходзіцца 5 электронаў, найніжэйшая –3. Электраадмоўнасць: χ(N) = 3,0.
4. Простае рэчыва азот з’яўляецца неметалам, агрэгатны стан пры н. у. — газ, хімічная формула N2.
5. Формула вышэйшага аксіду , аксід азоту (V), кіслотны;
формула гідраксіду, адпаведнага вышэйшаму аксіду, , гідраксід кіслотны, азотная кіслата;
вадароднае злучэнне , лятучае, паколькі азот з’яўляецца неметалам.
Менавіта пазнанне заканамернасцей дазволіла Д. І. Мендзялееву не проста прадказаць існаванне многіх элементаў, але і скласці досыць дакладную характарыстыку іх уласцівасцей. На момант стварэння табліцы было вядома ўсяго толькі 63 хімічныя элементы. Для неадкрытых элементаў у табліцы яму давялося пакінуць пустыя месцы, каб не парушаць перыядычнасць. Так, элемент, які павінен ісці за цынкам і размяшчацца пад алюмініем, ён назваў экаалюмініем. Д. І. Мендзялееву няцяжка было здагадацца, што яго адносная маса будзе каля 70, бо ў цынку яна роўная 65, а ў наступнага вядомага на той час элемента мыш’яку — 75. Злучэнні алюмінію з хлорам пры высокай тэмпературы валодаюць лятучасцю, значыць, і аналагічнае злучэнне экаалюмінію павінна быць лятучым. Апісанне ўласцівасцей экаалюмінію ён закончыў словамі: «Можна спадзявацца, што ён будзе адкрыты спектральным даследаваннем, падобна да таго, як адкрыты наступныя за ім індый і талій…» Такім чынам, было дадзена не толькі апісанне ўласцівасцей, але і спосаб знаходжання, зададзены кірунак пошуку.
Прайшло пяць гадоў, і французскі вучоны Л. дэ Буабадран спектральным метадам адкрыў новы элемент (галій), вылучыўшы яго з мінералу, здабытага ў Пірэнейскіх гарах. Вучоны быў нямала здзіўлены, калі праз Парыжскую акадэмію навук атрымаў ліст з Расіі. У ім паведамлялася, што ў апісанні ўласцівасцей галію правільна ўсё, акрамя шчыльнасці — не 4,7, а 5,9. Зрабіўшы больш якасную ачыстку металу, Буабадран пераканаўся, што першапачаткова была дапушчана памылка: шчыльнасць усё ж такі складала 5,9.
Вы, напэўна, паспелі здагадацца, што аўтарам ліста быў, вядома, Д. І. Мендзялееў.
Па становішчы элемента ў перыядычнай сістэме можна даць даволі поўную яго характарыстыку, у тым ліку звесткі пра будову атама, магчымыя ступені яго акіслення і значэнні электраадмоўнасці, састаў і ўласцівасці злучэнняў атамаў дадзенага элемента, уключаючы кіслотна-асноўныя і акісляльна-аднаўленчыя.
Пытанні, заданні, задачы
1. У чым вы бачыце значэнне перыядычнага закону і перыядычнай сістэмы Д. І. Мендзялеева для развіцця навукі?
2. Па прыведзеным у тэксце параграфа плане складзіце апісанне наступных хімічных элементаў:
- а) сера;
- б) хлор;
- в) алюміній;
- г) натрый.
3. Апішыце становішча ў перыядычнай сістэме элементаў, якія маюць канфігурацыю знешняга электроннага слоя:
- а) 4s1;
- б) 3s23p6;
- в) 2s22p2;
- г) 2s22p3.
4. Складзіце ўраўненні рэакцый, якія пацвярджаюць кіслотныя ўласцівасці:
- а) вышэйшага аксіду серы;
- б) гідраксіду, адпаведнага вышэйшаму аксіду азоту.
5. Складзіце ўраўненні рэакцый з салянай кіслатой:
- а) аксіду і гідраксіду магнію;
- б) аксіду і гідраксіду літыю.
6. Складзіце ўраўненні рэакцый, якія пацвярджаюць амфатэрнасць:
- а) аксіду цынку;
- б) аксіду алюмінію;
- в) гідраксіду цынку;
- г) гідраксіду алюмінію.
7. У кожнай пары пакажыце элемент з большай электраадмоўнасцю:
- а) Si і S;
- б) N і F;
- в) Сl і I;
- г) S і Se;
- д) P і Cl;
- е) С і Рb.
8. Зыходзячы са становішча элементаў у перыядычнай сістэме, параўнайце кіслотныя ўласцівасці гідраксідаў:
- а) крэмнію і серы;
- б) азоту і фосфару.
9. Да адкрыцця перыядычнага закону адносная атамная маса берылію прымалася роўнай 13,8, а формула яго аксіду запісвалася як Be2O3. Д. І. Мендзялееў змясціў гэты элемент у адну групу з магніем. Вызначце, як пры гэтым павінна была змяніцца атамная маса берылію. Адказ пацвердзіце разлікам.
10. Адносная шчыльнасць па вадародзе вадароднага злучэння саставу Н2Э роўная 17. Устанавіце элемент.
*Самакантроль
1. У IVА-групе ў 3-м перыядзе размешчаны элемент:
- а) Sc;
- б) Ga;
- в) Al;
- г) Si.
2. Хімічнаму элементу з атамным нумарам 35 адпавядаюць запісы:
- а) 2е–, 8е–, 18е–, 7е–;
- б) 2е–, 8е–, 7е–;
- в) 1s22s22p63s23p64s23d104р5;
- г)
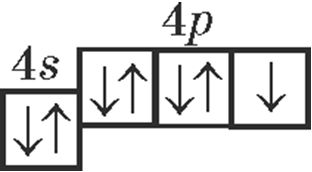 .
.
3. Найвышэйшы гідраксід саставу Н2ЭО4 маюць элементы:
- а) C;
- б) Cr;
- в) Se;
- г) S.
4. Солі ўтвараюцца ў рэакцыях кіслот з найвышэйшымі аксідамі элементаў:
- а) Sr;
- б) N;
- в) K;
- г) Сl.
5. Формула лятучага вадароднага злучэння элемента 5-га перыяду Н2Э. Укажыце гэты элемент:
- а) О;
- б) Sr;
- в) Te;
- г) S.