§ 3.1. Аксіды
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 3.1. Аксіды |
| Напечатано:: | Гость |
| Дата: | Суббота, 16 Август 2025, 14:33 |
Наменклатура і класіфікацыя аксідаў
Аксідамі называюць складаныя рэчывы, якія складаюцца з двух элементаў, адзін з якіх — кісларод (ЭхОу). Кісларод у аксідах праяўляе ступень акіслення –2: ;
.
У звычайных умовах аксіды могуць быць у газападобным (CO2, NO), вадкім (H2O) і часцей за ўсё ў цвёрдым стане (мал. 6.2).

Злучэнне OF2 адносяць да фтарыдаў, бо ў гэтым злучэнні фтор — больш электраадмоўны элемент, а ступень акіслення кіслароду +2: .
Акрамя аксідаў, існуе некалькі груп бінарных кіслародзмяшчальных рэчываў — пераксіды (Н2О2, Na2O2), надпераксіды (KO2, RbO2, CsO2) і азаніды (KO3, CsO3). Атамы кіслароду ў іх злучаныя паміж сабой кавалентнай сувяззю. Ступень акіслення кіслароду ў іх розная: ,
,
. Усе гэтыя рэчывы з’яўляюцца моцнымі акісляльнікамі.
Назвы аксідаў складаюцца са слова «аксід» і назвы элемента, напрыклад: Li2O — аксід літыю. Нагадаем, што ў выпадку існавання атамаў элемента ў некалькіх дадатных ступенях акіслення гэтую ступень у назвах або формулах аксідаў, асноў, солей паказваюць рымскімі лічбамі. Іх ставяць у дужках пасля назвы адпаведнага элемента, напрыклад: аксід жалеза(III), гідраксід жалеза(II), хларыд жалеза(II).
Існуюць аксіды, у якіх атамы металу знаходзяцца ў розных ступенях акіслення, напрыклад аксід жалеза(II, III) Fe3O4, або FeO ∙ Fe2O3.
Адрозніваюць солеўтваральныя (асноўныя, амфатэрныя, кіслотныя) і нясолеўтваральныя аксіды.
Да кіслотных адносяць аксіды, якія адпавядаюць кіслотам: ,
. Гэта, як правіла, аксіды неметалаў (напрыклад,
), аксіды металаў з высокімі значэннямі ступені акіслення +5, +6, +7 (напрыклад,
). Кіслотныя аксіды часта называюць ангідрыдамі кіслот (напрыклад, P2O5 — фосфарны ангідрыд).
Аксіды, якім адпавядаюць асновы, называюць асноўнымі: K2O — KОН, ВаО — Ва(ОН)2. Да іх адносяцца выключна аксіды металаў.
Амфатэрныя аксіды (Al2O3, Cr2O3, ZnO, BeO) у залежнасці ад умоў могуць праяўляць уласцівасці як кіслотных, так і асноўных аксідаў.
Хімічныя ўласцівасці аксідаў
Хімічныя ўласцівасці солеўтваральных аксідаў паказаны ў табліцы 1.1.
Табліца 1.1. Хімічныя ўласцівасці солеўтваральных аксідаў
| Асноўныя (Na2O, СаО, MgO, FeO — аксіды металаў) |
Амфатэрныя (Al2O3, Cr2O3, ZnO, BeO — аксіды металаў) |
Кіслотныя (SO3, CO2, P2O5, CrO3 — аксіды і металаў, і неметалаў) |
| Рэагуюць: | ||
| з вадой: | ||
|
Аксіды шчолачных і шчолачназямельных металаў СаО + Al2O3 |
— |
(акрамя SiO2): SO3 + H2O = H2SO4 |
| з кіслотамі: | ||
| МgO + 2HCl = MgCl2 + H2O | ZnO + 2HCl = ZnCl2 + H2O | — |
| са шчолачамі: | ||
| — |
ZnO + 2NaOH(цв) ZnO + Н2О + 2NaOH(р-р) = Na2[Zn(OH)4] |
CO2 + Са(ОН)2 = CaCO3 + Н2О |
| з кіслотнымі аксідамі: | ||
| CaO + SiO2 |
Аl2O3 + Р2O5 |
— |
| з асноўнымі аксідамі: | ||
| — | ВаО + Al2O3 |
3CaO + Р2O5 |
| з амфатэрнымі аксідамі: | ||
| СаО + Al2O3 |
ZnO + Al2O3 |
ZnО + SiO2 |
Да нясолеўтваральных аксідаў адносіцца невялікая колькасць аксідаў неметалаў з нізкімі значэннямі ступені акіслення: . Пры пакаёвай тэмпературы яны не ўтвараюць солі ні з кіслотамі, ні са шчолачамі. Аднак для іх характэрны рэакцыі са змяненнем ступені акіслення элемента, які ўтварае аксід.
Акісляльна-аднаўленчыя ўласцівасці могуць праяўляць не толькі нясолеўтваральныя, але таксама асноўныя, кіслотныя і амфатэрныя аксіды. У якасці прыкладаў прывядзём некаторыя практычна значныя ператварэнні аксідаў:
(прамежкавая стадыя вытворчасці азотнай кіслаты);
(атрыманне жалеза, доменны працэс);
(атрыманне вальфраму);
(атрыманне крэмнію).
Атрыманне аксідаў
Аксіды атрымліваюць акісленнем кіслародам простых і складаных рэчываў (як неарганічных, так і арганічных), а таксама тэрмічным раскладаннем гідраксідаў (кіслот, асноў, амфатэрных гідраксідаў), кіслародзмяшчальных солей (табл. 1.2).
Табліца 1.2. Спосабы атрымання аксідаў
| Спосабы атрымання аксідаў | ||
|---|---|---|
| Узаемадзеянне простых і складаных рэчываў з кіслародам | Раскладанне складаных рэчываў — асноў, солей, кіслот | Іншыя спосабы |
Некаторыя металы (Мg, Zn), а таксама вуглярод утвараюць аксіды ў рэакцыях з парамі вады. Дадаткова адзначым лабараторны спосаб атрымання аксіду вугляроду(IV) рэакцыяй абмену, у якой выкарыстоўваюць мармур і саляную кіслату:
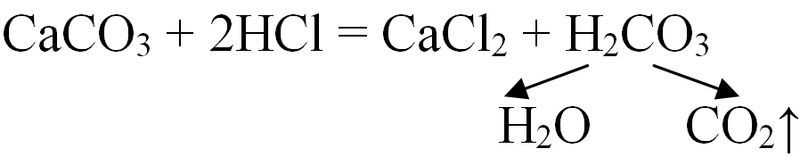
Атрыманы аксід СО2 можна разглядаць як прадукт раскладання вугальнай кіслаты.
Варта таксама памятаць, што пры акісленні кіслародам азотазмяшчальных рэчываў (аміяку NH3, амінаў RNH2 і інш.) азот вылучаецца ў выглядзе простага рэчыва N2, а аксід азоту(II) утвараецца ў прысутнасці каталізатара.
Аксіды — складаныя рэчывы, якія складаюцца з двух элементаў, адным з якіх з’яўляецца кісларод. Адрозніваюць солеўтваральныя (асноўныя, амфатэрныя, кіслотныя) і нясолеўтваральныя аксіды.
Кіслотныя аксіды рэагуюць з вадой, асноўнымі аксідамі і шчолачамі, асноўныя аксіды — з вадой, кіслотнымі аксідамі і кіслотамі. Амфатэрныя аксіды ўступаюць у рэакцыі як з кіслотамі, так і са шчолачамі, а таксама з іншымі солеўтваральнымі аксідамі.
Распаўсюджаныя спосабы атрымання аксідаў — узаемадзеянне простых і складаных рэчываў з кіслародам і тэрмічнае раскладанне асноў, кіслародзмяшчальных солей або кіслот.
Пытанні, заданні, задачы
1. Назавіце аксіды:
- а) элементаў з пастаяннай валентнасцю — K2O, Al2O3, MgO;
- б) элементаў са зменнай валентнасцю — Ag2O, SO3, Mn2O7.
2. Складзіце формулы аксідаў:
- а) кальцыю, медзі(II), медзі(I), хрому(III), жалеза(III), азоту(IV);
-
б) адпаведных кіслотам:
Кіслата Кіслотны аксід -
в) адпаведных асновам:
Аснова LiOH NaOH Ba(OH)2 Ca(OH)2 Fe(OH)2 Sr(OH)2 Асноўны аксід
3. Складзіце ўраўненні рэакцый, якія характарызуюць уласцівасці аксідаў:
- а) ВаО і FeO;
- б) SiO2 і SO2;
- в) MgO і ZnO.
Укажыце прычыны падабенства і адрознення ўласцівасцей аксідаў у кожнай пары.
4. Напішыце ўраўненні рэакцый узаемадзеяння з кіслародам наступных рэчываў: Сu, Al, ZnS, C2H2, С2Н5NH2, CH3OH.
5. Складзіце ўраўненні рэакцый згодна са схемамі:
- а)
- б)
- в)
- г)
- д)
- е)
.
6. Дадзены пералік аксідаў, формулы якіх MgO, ZnO, NO, SiO2, SO3, P2O5, K2O. Якія з пералічаных аксідаў будуць рэагаваць:
- а) з гідраксідам натрыю;
- б) з сернай кіслатой?
Складзіце ўраўненні адпаведных рэакцый.
7. Разлічыце аб’ём (н. у.) сярністага газу, які ўтвараецца пры абпале пірыту FeS2 масай 10 т, масавая доля прымесей у ім складае 6,25 %. Вызначце масу сернай кіслаты, якая магла быць атрымана пры гэтым.
8. У сталовай лыжцы змяшчаецца прыкладна 25 г воцату. Вызначце аб’ём вуглякіслага газу, які вылучыцца пры ўзаемадзеянні такой порцыі воцату з пітной содай. Масавая доля воцатнай кіслаты ў сталовым воцаце складае 9 %.
9. Малярная маса сумесі аксідаў вугляроду СO і СО2 роўная 32 г/моль. Вызначце аб’ёмную долю аксіду вугляроду(II) у сумесі.
10. Сумесь аксідаў магнію і кальцыю масай 1,52 г растварылі ў азотнай кіслаце. Пры асцярожным выпарванні і сушцы атрымалі сумесь солей масай 4,76 г. Вызначце масы аксідаў у зыходнай сумесі.
Самакантроль
1. Аксідамі з’яўляюцца рэчывы, формулы якіх:
- а) MgO;
- б) Н2О2;
- в) Fe2O3;
- г) OF2.
2. Толькі кіслотныя аксіды пазначаны ў радах:
- а) MgO, ZnO, NO;
- б) SiO2, SO3, P2O5;
- в) FeO, SiO2, SO2;
- г) N2O5, СO2, Mn2O7.
3. Правільнымі ў адносінах да аксіду барыю з’яўляюцца сцвярджэнні:
- а) амфатэрны;
- б) рэагуе з вадой;
- в) уступае ў рэакцыю з кіслотнымі аксідамі;
- г) пры падвышанай тэмпературы рэагуе з аксідам алюмінію.
4. Выберыце схемы здзяйсняльных рэакцый:
- а) СаО + HCl →;
- б) Al2O3 + Н2О →;
- в) ZnO + NaOH →;
- г) MgO + KOH →.
5. Колькасць сернай кіслаты, якая рэагуе з аксідам жалеза(II, III) масай 2,32 г, роўная:
- а) 2 моль;
- б) 4 моль;
- в) 0,04 моль;
- г) 0,2 кмоль.