§ 47. Металлы IIA-группы периодической системы
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 47. Металлы IIA-группы периодической системы |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 1 Июнь 2025, 16:12 |
Металлы IIA-группы периодической системы
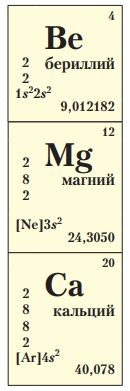 В группе IIA периодической системы находятся бериллий Be, магний Mg и принадлежащие подгруппе щёлочноземельных металлов кальций Са, барий Ва, стронций Sr, радий Ra. Своё название щёлочноземельные металлы получили потому, что в древние времена землями называли выделяемые из минералов и горных пород тугоплавкие оксиды многих металлов. При взаимодействии с водой растворимые «земли» образовывали раствор щёлочи. Именно к таким растворимым оксидам металлов IIA-группы относятся CaO, BaO, SrO. Be и Mg по многим свойствам схожи со щёлочноземельными металлами, однако их основания нерастворимы, поэтому они не входят в группу щелочей.
В группе IIA периодической системы находятся бериллий Be, магний Mg и принадлежащие подгруппе щёлочноземельных металлов кальций Са, барий Ва, стронций Sr, радий Ra. Своё название щёлочноземельные металлы получили потому, что в древние времена землями называли выделяемые из минералов и горных пород тугоплавкие оксиды многих металлов. При взаимодействии с водой растворимые «земли» образовывали раствор щёлочи. Именно к таким растворимым оксидам металлов IIA-группы относятся CaO, BaO, SrO. Be и Mg по многим свойствам схожи со щёлочноземельными металлами, однако их основания нерастворимы, поэтому они не входят в группу щелочей.
Общие сведения о металлах IIA-группы
В таблице 33 суммированы сведения о строении и свойствах атомов металлов IIA-группы.
По электронному строению атомов элементы IIA-группы относятся к s-элементам. На внешнем электронном слое их атомов имеется 2 электрона (ns2), во всех своих соединениях они проявляют положительную степень окисления +2. Как и щелочные, металлы IIA-группы являются сильными восстановителями. Атомные радиусы элементов IIA-группы меньше радиусов атомов соседних щелочных металлов, а их внешние электроны прочнее связаны с ядрами. Соответственно, электроотрицательность металлов IIA-группы выше, чем у металлов IA-группы, поэтому они несколько менее активны (см. табл. 32 и 33).
Как и у щелочных металлов IA-группы, с увеличением порядкового номера у элементов IIA-группы возрастает атомный радиус, уменьшается электроотрицательность, усиливаются металлические свойства и в основном уменьшается температура плавления. Так, Tпл. (Ca) = 850 °C, Tпл. (Sr) = 777 °C,
Таблица 33. Характеристики атомов металлов IIA-группы
| Элемент | Be | Mg | Ca | Sr | Ba | Ra |
| Электронная конфигурация | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Атомный радиус, нм | 0,113 | 0,160 | 0,197 | 0,215 | 0,221 | 0,235 |
| Электроотрицательность | 1,6 | 1,3 | 1,0 | 0,95 | 0,9 | 0,9 |
Tпл. (Ba) = 727 °C. Обратите внимание, что температуры плавления металлов IIA-группы выше, чем их аналогов IA-группы. Этот факт обусловлен упрочнением металлической связи с увеличением числа электронов на внешнем электронном слое атомов.
Соединения кальция и магния распространены в природе достаточно широко. К важнейшим из них относятся магнезит MgCО3, доломит CaMg(CO3)2, кальцит CaCO3, гипс CaSO4 · 2H2O, флюорит CaF2 и различные силикаты. Соединения других элементов IIA-группы менее распространены. Стронций и барий находятся в природе в виде карбонатов и сульфатов. Радий, являясь радиоактивным элементом, присутствует в урановых рудах как продукт распада урана.
Распознать присутствие того или иного металла в соединении можно по окраске пламени. В присутствии соединений кальция цвет пламени кирпично-красный, стронция и радия — карминово-красный, бария — желтовато-зелёный. Соединения магния пламя не окрашивают (Приложение 3).
Металлы IIA-группы, как правило, получают электролизом расплава хлоридов (§ 45, рис. 108).
Химические свойства металлов IIA-группы и их соединений
Восстановительная способность металлов IIA-группы возрастает с увеличением атомного номера. При взаимодействии с неметаллами они образуют оксиды (CaО), гидриды (CaН2), нитриды (Ca3N2), галогениды (CaСl2), карбиды (CaС2), сульфиды (CaS) и т. д.
Щёлочноземельные металлы активно реагируют с водой и кислотами, вытесняя из них водород.
В соединениях металлов IIA-группы с неметаллами образуются химические связи преимущественно ионного характера.

Особняком находится лишь бериллий, атомы которого имеют значительно меньшие размеры и поэтому более склонны к образованию связей ковалентного характера.
Химическая активность оксидов и гидроксидов металлов IIA-группы увеличивается с возрастанием атомного номера металла.
Соли элементов IIA-группы имеют различную растворимость, что связано с различием в размере их атомов.
Наряду с общими химическими свойствами у каждого из металлов IIA-группы и его соединений есть свои особенности.
Бериллий по многим свойствам отличается от других элементов IIA-группы. На воздухе поверхность бериллия покрывается стойкой оксидной плёнкой BeO, что, очевидно, обусловливает его низкую реакционную способность. Оксид и гидроксид бериллия проявляют амфотерные свойства:
Сплавы на основе бериллия отличаются повышенной твёрдостью, прочностью и коррозионной устойчивостью. Они используются в атомной энергетике, для обшивки космических аппаратов, для изготовления огнеупорных материалов.
Соединения бериллия токсичны.
Магний — металл серебристо-белого цвета. На воздухе поверхность магния покрывается оксидной плёнкой MgO, что препятствует его дальнейшему окислению кислородом. При нагревании до 300–400 °С магний сгорает ослепительно ярким пламенем (рис. 110):
Металлический магний очень медленно реагирует с холодной водой, но в кипящей воде эта реакция протекает интенсивнее:
Mg + 2H2О = Mg(ОH)2↓ + H2↑.
Сочетание лёгкости (плотность примерно на 35 % меньше, чем у алюминия) и высокой прочности (почти в 2 раза выше, чем у алюминия) делает сплавы на основе магния востребованными в авиа-, автомобиле- и приборостроении.
Оксид магния MgO — порошок белого цвета, весьма тугоплавок. Взаимодействует с водой только при кипячении, образуя нерастворимый гидроксид:
Получают оксид магния прокаливанием карбоната магния:
Оксид магния используют в изготовлении огнеупорных изделий (кирпичей, тиглей, цемента и т. д.), а также в медицине для снижения кислотности желудочного сока.
Гидроксид магния Mg(OH)2, будучи нерастворимым основанием, всё же создаёт в воде щелочную среду (рН > 7, обнаруживается фенолфталеином), так как переходящий в раствор в ничтожно малом количестве гидроксид диссоциирует:
Mg(ОН)2 → Mg2+ + 2ОН–.
Mg(OH)2 как основание растворяется в кислотах:
Mg(OH)2 + 2НСl = MgCl2 + 2Н2О.
Его получают при действии щелочей на растворимые соли магния. При этом выпадает белый студенистый осадок:
MgCl2 + 2КОН = Mg(ОН)2↓ + 2КСl.
Соли магния. Растворимые соли магния бесцветны и горьки на вкус, но не ядовиты. Из растворимых солей магния наиболее значимы хлорид и сульфат.
MgCl2, содержащийся в морской воде, служит основным ресурсом для получения металлического магния электролизом. MgSО4 · 7Н2О — горькая английская соль, находит применение в растениеводстве как микроудобрение (источник магния и серы), медицине (компонент успокаивающих, противосудорожных, спазмолитических препаратов и средств для понижения давления).
Биологическая роль. Магний входит в состав хлорофиллов — зелёного пигмента растений, необходимого для осуществления процесса фотосинтеза. Недостаток ионов Mg2+ в организме человека вызывает тяжёлые нарушения сердечной деятельности, повышает предрасположенность к инфарктам.
Кальций — серебристо-белый лёгкий металл. Кальций и другие щёлочноземельные металлы по своим свойствам похожи на магний, но обладают гораздо большей химической активностью.
Оксид кальция — белый тугоплавкий порошок, имеет техническое название — жжёная, или негашёная, известь. Это типичный основный оксид: он реагирует с водой, кислотами и кислотными оксидами.
Процесс взаимодействия CaO с водой называют гашением: СаО +
Эта реакция сопровождается большим выделением теплоты.
В промышленности оксид кальция получают обжигом при 900 °С известняка или мела:
Гидроксид кальция Са(ОН)2 — белый порошок, мало растворим воде (1,56 г на 1 дм3 воды при 20 °С), но полностью диссоциирует, образуя сильнощелочной раствор (рН = 12,6):
Ca(OH)2 → Ca2+ + 2OH–.
Как типичное основание гидроксид кальция реагирует с кислотами, кислотными оксидами, растворами солей.
При пропускании углекислого газа через известковую воду вначале появляется осадок карбоната:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О,
который затем полностью исчезает из-за образования растворимого гидрокарбоната кальция Са(НСО3)2:
Гидрокарбонат кальция неустойчив, он существует только в растворе. С этими процессами связано образование пещер в известняковых массивах, а в них — сталактитов и сталагмитов.

Раствор гидроксида кальция Са(ОН)2 называют известковой водой. Суспензию гидроксида кальция называют известковым молоком. Твёрдый гидроксид кальция называют гашёной известью.
Гашёную известь, или «пушонку», применяют в строительстве, а также для снижения временной жёсткости воды, уменьшения кислотности почв.
Соли кальция. Карбонат кальция СаСО3 — белое вещество, нерастворимое в воде. Из него сформирован мел, мрамор, жемчуг, ракушки моллюсков (рис. 111).

Сульфат кальция существует в природе в виде двух минералов — ангидрита (CaSO4) и гипса (CaSО4 · 2H2О). Они плохо растворимы в воде. При прокаливании гипса образуется строительный гипс — алебастр («жжёный гипс») — CaSО4 · 0,5H2О. Его применяют как вяжущее средство в строительстве для изготовления панелей, перегородок, сухой штукатурки, барельефов, орнаментов и др., а также в медицине для наложения гипсовых повязок. Твердение жжёного гипса происходит в результате реакции гидратации:
CaSО4 · 0,5H2О + 1,5Н2О = CaSО4 · 2H2О + Q.
Хлорид кальция CaCl2 в виде раствора применяется как лекарственное средство, восполняющее дефицит ионов Ca2+ в организме человека. Катионы Са2+ участвуют в регуляции сердечных сокращений и свёртываемости крови, а также в формировании костной ткани.
Дефицит кальция снижает плодородие почв, вызывает болезни скелета человека и животных, замедляет рост организма. Поэтому большое значение имеет обогащение кальцием почв, кормов для домашних животных и т. д.
Жёсткость воды и способы её уменьшения

Соединения магния и кальция являются основным компонентом горных пород, составляющих верхнюю часть земной коры. Вода, проходя через эти породы, насыщается этими соединениями, становясь «жёсткой». При нагревании жёсткой воды на нагревателях стиральных машин, трубах теплоцентралей, на внутренних стенках котлов ТЭЦ и чайников образуется накипь, состоящая из карбонатов кальция и магния (рис. 112). Накипь обладает низкой теплопроводностью, поэтому вызывает перегрев стенок котлов. Случайное отделение части накипи от раскалённой стенки котла может привести к быстрому испарению воды, повышению давления внутри котла и его взрыву. Жёсткая вода оставляет разводы на посуде, поверхности сантехники. В жёсткой воде повышен расход моющих средств.
Процесс устранения жёсткости воды перед её использованием называется умягчением воды. Любой из его вариантов предполагает удаление из воды ионов кальция и магния. По отношению к процессам умягчения воды различают жёсткость временную и постоянную.
Временная (карбонатная, или устранимая кипячением) жёсткость обусловлена содержанием в воде гидрокарбонатов кальция и магния. Она устраняется кипячением, при котором происходит полное разложение гидрокарбонатов. Они переходят в виде карбонатов в нерастворимое состояние:
Са(НСО3)2 СаСО3↓ + СО2↑ + Н2О;
Mg(НСО3)2 MgСО3↓ + СО2↑ + Н2О.
Именно такие реакции вызывают образование накипи на чайнике.
Постоянная (некарбонатная) жёсткость обусловлена содержанием растворимых солей кальция и магния (сульфатов, хлоридов и др.), которые при кипячении остаются в растворе. В этом случае жёсткость воды может быть устранена введением в раствор реагентов (Nа2CO3, Na3РO4, Са(ОН)2 и др.), образующих с растворёнными солями кальция и магния осадки:

Уменьшить количество растворённых солей в воде можно её вымораживанием. Постепенно замораживая воду, оставляют примерно 10 % жидкости от первоначального количества. При образовании льда растворённые соли накапливаются в жидкой фазе, где их растворимость выше. Оставшуюся воду сливают, а лёд затем расплавляют.
В лаборатории для очистки воды используют метод перегонки, то есть испарение воды с последующей её конденсацией. При этом основная часть солей остаётся в неиспарившейся воде. Конденсированная вода называется дистиллированной.
Современный, более экономичный способ основан на применении ионообменных смол. При пропускании воды через слой ионообменной смолы (ионита) ионы кальция, магния и железа переходят в состав смолы, а из смолы в раствор переходят ионы Н+ или Na+:
Ca2+ + Na2R = 2Na+ + CaR,
где Na2R — условное обозначение ионита, синтетической органической смолы, на поверхности которой находятся ионы Na+.
Металлы IIA-группы — s-элементы с общей электронной конфигурацией валентного слоя ns2. В соединениях с неметаллами образуют химические связи преимущественно ионного характера и находятся в степени окисления +2.
Являются сильными восстановителями, но менее активными, чем щелочные металлы. Оксиды и гидроксиды бериллия обладают амфотерными свойствами, остальных элементов — основными.
Растворимые соли кальция и магния обусловливают жёсткость воды.
Металлы IIA-группы получают электролизом расплавов солей.
Вопросы, задания, задачи
- Как доказать, что оксид магния при кипячении в воде переходит в гидроксид, который хотя и плохо, но всё же растворяется в воде?
- По термохимическому уравнению определите количество теплоты, выделившейся при сгорании в кислороде магния массой 1 г.
- Чем можно объяснить образование осадка в растворе гидроксида бария при его хранении в открытой колбе?
- Какая вода наименее жёсткая: артезианская, речная или дождевая? Ответ поясните.
- Предложите план распознавания растворов нитратов кальция и натрия, находящихся в двух пронумерованных пробирках.
- Постоянная жёсткость воды может быть устранена применением реагентов, образующих с растворёнными солями кальция и магния осадки. Используя таблицу растворимости, предложите эти реагенты и приведите для иллюстрации необходимые уравнения возможных реакций.
- Предложите способ очистки чайника от накипи, исходя из её химического состава.
- Анализ забора воды из скважины показал, что содержание в ней ионов кальция составляет 0,2 г на 1 дм3 воды. Определите массу кальцинированной соды, которая понадобится для уменьшения содержания кальция до 0,04 г/дм3 в такой воде объёмом 100 м3.
- Составьте три уравнения реакций согласно схеме:

- Составьте уравнения реакций согласно схеме:
*Самоконтроль
1. Основные компоненты ракушечника и гипса соответственно:
- а) MgCO3 и CaSO4 ∙ 2H2O;
- б) CaSO4 ∙ 0,5H2O и CaCO3;
- в) CaSO4 и CaMg(CO3);
- г) CaCO3 и CaSO4 ∙ 2H2O.
2. В ряду металлов Mg—Ca—Ba:
- а) размер атома увеличивается;
- б) электроотрицательность уменьшается;
- в) число электронов на внешнем слое увеличивается;
- г) представлены s-, p- и d-элементы.
3. Металлы IIА-группы можно получить электролизом расплава соли:
- а) MgCO3;
- б) MgCl2;
- в) CaCl2;
- г) CaSO4 ∙ 2H2O.
4. И бериллий, и кальций реагируют с:
- а) H2O (20 °С);
- б) O2;
- в) HCl;
- г) NaOH.
5. Жёсткость воды можно уменьшить, добавляя:
- а) Na2CO3;
- б) NaCl;
- в) K3PO4;
- г) Na3PO4.