§ 45.1. Получение металлов электролизом водных растворов солей
Примеры использования электролиза водных растворов солей металлов в промышленности и в лаборатории
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
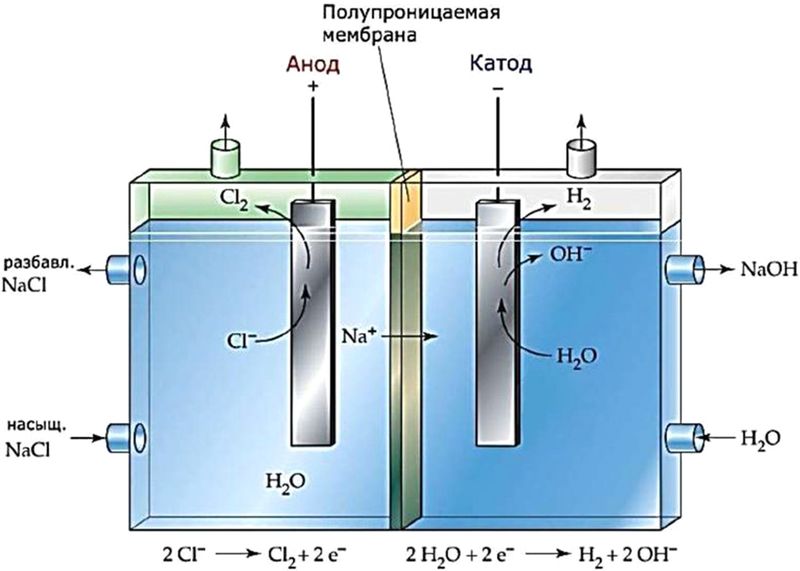
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
2Н2О + 2е– = Н2↑ + 2ОН–,
на аноде — хлор:
2Cl– – 2e– = Cl2↑,
а в растворе накапливается каустическая сода:
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑.
Если не разделить продукты электролиза, то между образовавшимися газами произойдёт химическая реакция.
В растворе также возможно взаимодействие хлора со щёлочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).
С 2015 года в ОАО «Беларуськалий» функционирует цех мембранного электролиза. Продукцией цеха являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 %); твёрдый гидроксид калия (с массовой долей KOH 90−95 %); соляная кислота (с массовой долей HCl 28−35 %); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.
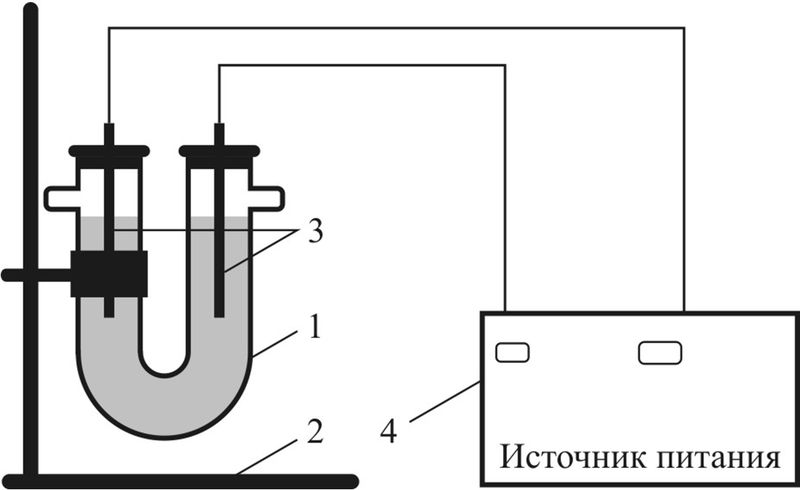
1 — U-образная трубка (электролизёр);
2 — штатив;
3 — электроды (графитовые стержни);
4 — источник питания постоянного тока
Опыт 1. Проведём электролиз водного раствора CuSO4. Для этого соберём прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальём раствор сульфата меди(II) и опустим два графитовых стержня, закреплённых в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.

При пропускании электрического тока через раствор CuSO4 на стержне, присоединённом к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединённом к отрицательному полюсу (катод), — появление красного налёта (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
CuSO4 → Cu2+ + .
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налёт на электроде:
Сu2+ + 2e– = Сu0
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
2Н2О – 4e– = О2↑ + 4Н+.
Суммарное уравнение процессов на электродах в молекулярной форме:
2СuSO4 + 2Н2О 2Сu0 + О2↑ + 2Н2SO4.
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальём раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильём крахмальный клейстер.

Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение жёлто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щёлочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e– = Н2↑ + 2ОН– на катоде;
2I– – 2e– = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
2Н2О + 2KI Н2↑ + I2 + 2KОН.
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, её ионы переходят в раствор, перемещаются к катоду и на нём восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твёрдости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придаёт изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространённым промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
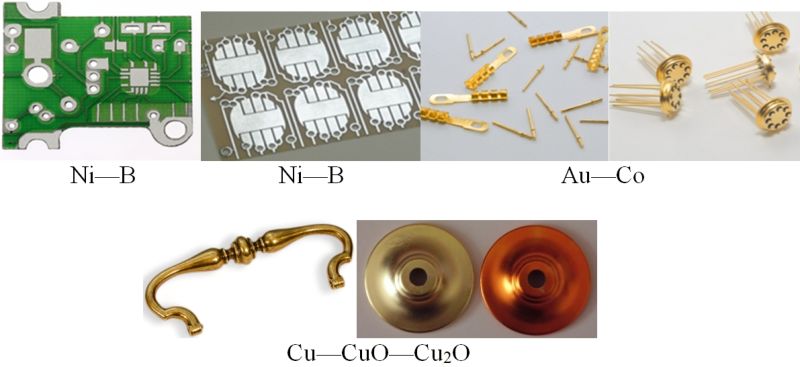
В НИИ физико-химических проблем Белорусского государственного университета разработаны и внедрены в промышленность процессы электрохимического осаждения покрытий из сплавов металлов и композиционных покрытий металл — оксид металла, например: Ni—B, Ni—P, Ni—Sn, Au—Co, Сu—CuO—Cu2O, Ni — алмаз (алмаз в виде тонко измельчённого порошка). Такие покрытия более твёрдые, износо- и коррозионностойкие, чем покрытия из индивидуальных металлов, обладают декоративным внешним видом (рис. 108.6).
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.