§ 37. Аммиак
Соли аммония
Реакции аммиака с кислотами позволяют получить разнообразные соли аммония.
Соли аммония представляют собой твёрдые кристаллические вещества, хорошо растворимые в воде. Их растворы являются сильными электролитами, диссоциирующими с образованием катиона аммония и аниона кислотного остатка:
Важнейшей особенностью солей аммония является взаимодействие со щелочами с выделением аммиака:
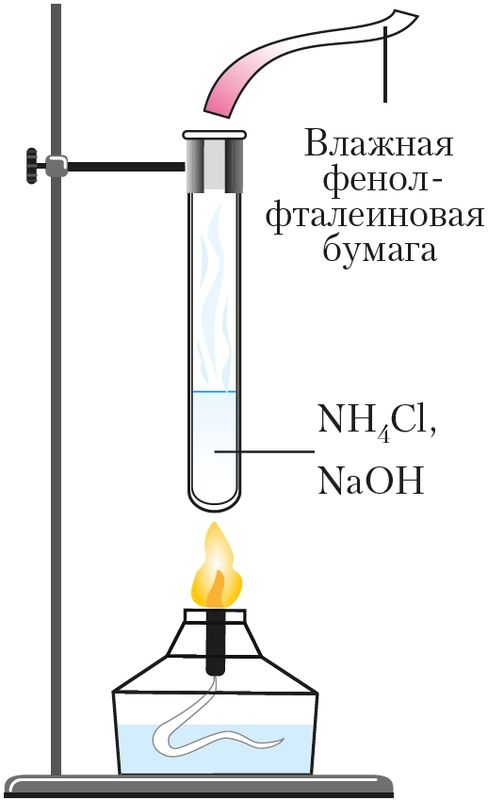
Взаимодействие солей аммония со щелочами при нагревании используют для обнаружения ионов аммония (качественная реакция на ион ). Для этого к нагреваемой смеси подносят влажную индикаторную бумажку. В присутствии аммиака фенолфталеиновая бумага становится малиновой, лакмусовая — синей (рис. 93, Приложение 3).
Второй особенностью солей аммония является их термическая неустойчивость. Разложение каждой из солей аммония специфично. Так, широко используемые в качестве разрыхлителей для теста карбонат и гидрокарбонат аммония (пищевая добавка Е503) разлагаются уже при небольшом нагревании с образованием аммиака, углекислого газа и воды:
(NH4)2СO3 2NH3 + СО2 + Н2О;
NH4НСO3 NH3 + СО2 + Н2О.
Хлорид аммония разлагается на аммиак и хлороводород:
NH4Cl NH3 + HCl.
Применение аммиака и солей аммония. Основная часть производимого аммиака идёт на производство удобрений (аммиачная селитра NH4NO3, сульфат аммония (NH4)2SO4, мочевина (NH2)2СO и др.) и азотной кислоты. Аммиак востребован в производстве соды, красителей, полимеров. Его используют в животноводстве для повышения содержания азота в кормах. Аммиачную воду (18–25%-ный водный раствор) применяют как жидкое удобрение. Нашатырный спирт (водный раствор аммиака с массовой долей 3–10 %) используют в медицине. В быту нашатырный спирт применяют для выведения пятен с одежды, при чистке посуды, сантехники, ювелирных украшений, для мытья стёкол и хрусталя.
Не следует путать нашатырный спирт (NH3 ∙ H2O) с нашатырём — солью и минералом состава NH4Cl.
Нашатырь применяют в качестве удобрения на нейтральных и щелочных почвах, используют как флюс для удаления оксидной плёнки при пайке металлов, в гальванических элементах как компонент электролита (рис. 94), карбонат и гидрокарбонат аммония используют в качестве разрыхлителей для теста при выпечке.
