§ 36. Элементы VА-группы. Азот и фосфор
Фосфор как простое вещество
Фосфор, являясь элементом VА-группы, как и азот, способен образовывать молекулу состава P2. Однако, в отличие от молекулы азота, двухатомная молекула фосфора неустойчива. Поэтому фосфор существует в виде нескольких аллотропных модификаций, в которых реализуются лишь одинарные связи Р—Р: фосфор белый, красный, чёрный и другие (табл. 29).
Таблица 29. Строение и физические свойства аллотропных модификаций фосфора
| Аллотропные модификации фосфора | Строение | Температура плавления | Температура кипения |
|
Р4 фосфор белый  |
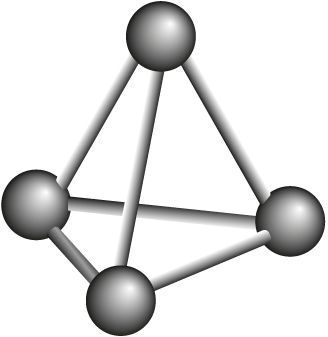 |
44 °С | 281 °С |
|
Р фосфор красный  |
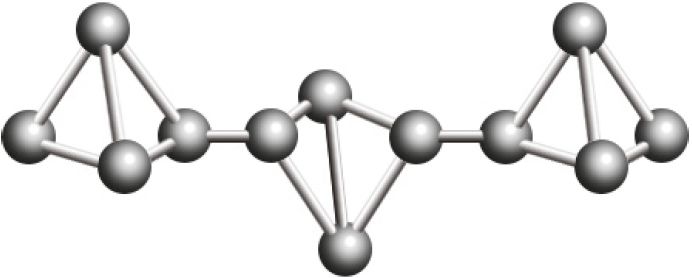 |
260 °С | ‒ Возгоняется при температуре около 400 °С |
|
* Р фосфор чёрный  |
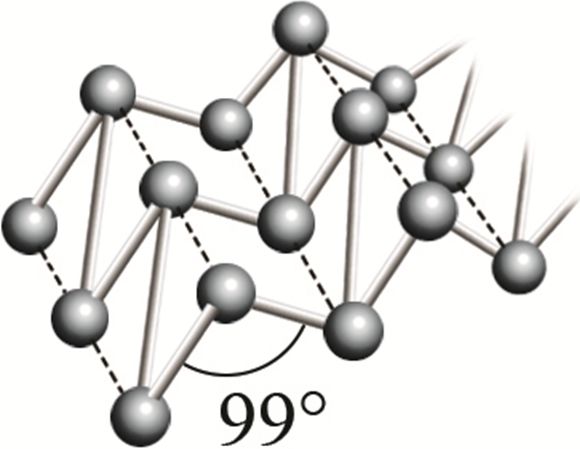
Фрагмент кристаллической решётки чёрного фосфора |
При нагревании (атмосферное давление) превращается в красный фосфор | 1000 °С (при 1,8 ∙ 106 атм) |

Физические свойства. Белый фосфор Р4 представляет собой воскообразное вещество с чесночным запахом, ядовит. На воздухе в темноте светится зеленовато-жёлтым цветом в результате медленной химической реакции окисления (хемилюминесценция (рис. 88)).
Красный фосфор — аморфное вещество полимерного строения, не имеет запаха, его токсичность невысокая.
Между аллотропными модификациями фосфора возможны взаимопревращения, протекающие при определённых температурах и давлениях.
Химические свойства. Как окислитель фосфор при нагревании вступает в реакции с металлами, образуя фосфиды:
С водородом фосфор не реагирует.
Как восстановитель фосфор реагирует с кислородом и другими сильными окислителями. В чистом кислороде и на воздухе фосфор ослепительно горит, образуя белый дым (частицы твёрдых оксидов фосфора):
(оксид фосфора(V) в избытке кислорода);
(оксид фосфора(III) при недостатке кислорода).
Белый фосфор может самовоспламеняться на воздухе, а красный загорается лишь при поджигании, что объясняется различной прочностью химических связей между атомами фосфора в аллотропных модификациях.
Фосфор получают прокаливанием смеси фосфата кальция с песком и углём:
Не реагируя с водородом непосредственно, фосфор тем не менее образует водородные соединения. Так, фосфин можно получить косвенно, например, из фосфидов, которые разрушаются как водой, так и кислотами: Mg3Р2 + 6H2O = 3Mg(ОН)2↓ + 2РH3↑.
Фосфин РH3 — газ с чесночным запахом.
В природе водородные соединения фосфора встречаются там, где происходит интенсивное разложение белковых веществ.
Применение. Белый фосфор используют для производства фосфорных кислот и их производных, в металлургии как компонент некоторых жаропрочных сплавов. Красный фосфор применяют в производстве спичек, в органическом синтезе (лекарственные препараты, ядохимикаты). Образцы фосфора, содержащие нуклид 32Р («меченый атом») с периодом полураспада 14,22 суток, используют в исследовательских работах.