§ 23. Растворение как физико-химический процесс
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 23. Растворение как физико-химический процесс |
| Напечатано:: | Гость |
| Дата: | Sunday, 7 December 2025, 17:39 |
Вы уже знакомы со смесями веществ — растворами и механическими смесями, их классификацией (рис. 50). Напомним, что механические смеси образуются в результате простого перемешивания веществ без образования ими химической связи или других химических изменений. Каждый компонент такой механической (гетерогенной) смеси сохраняет свой состав и свойства.
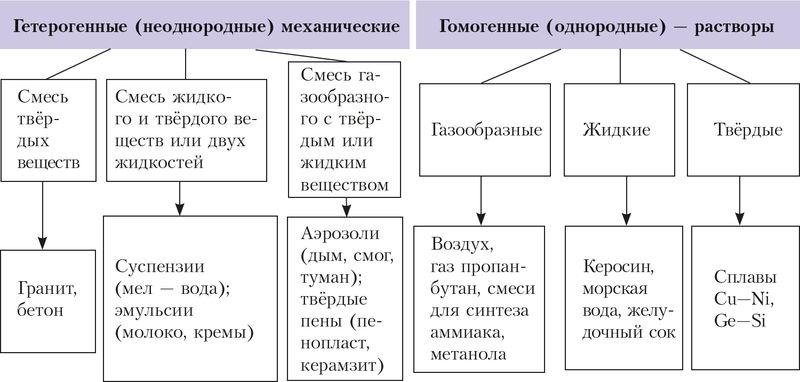
Также вам уже известны растворы — гомогенные устойчивые системы переменного состава, состоящие из нескольких компонентов. Различают жидкие (водные и неводные), газообразные и твёрдые растворы. Некоторые их примеры приведены на рисунке 50. Мы будем рассматривать преимущественно водные растворы.
В отличие от механических смесей растворы однородны, то есть отсутствуют границы раздела фаз. Кроме того, растворы устойчивы, так как при неизменных условиях (концентрация растворённого вещества, температура, давление) они бесконечно долго остаются гомогенными системами.
Физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя с образованием гомогенной устойчивой системы переменного состава, называют растворением.
Химическая сторона процесса растворения заключается в разрушении связей между частицами растворяемого вещества и их взаимодействии с молекулами растворителя. При растворении протекают физические процессы взаимной диффузии частиц растворяемого вещества и молекул воды.
*Твёрдые, жидкие и газообразные растворы
Растворитель — это компонент раствора, агрегатное состояние которого не изменяется при образовании раствора.
В жидких растворах и смесях газов растворитель — обычно компонент, количество которого в растворе преобладает. Тем не менее в водных растворах, независимо от концентрации растворённого вещества, растворителем считают воду, например раствор серной кислоты с массовой долей 98 %, медицинский спирт с массовой долей этанола 97 %.
В твёрдых веществах могут быть растворены газы, жидкости или другие твёрдые вещества. Так, в металлах хорошо растворяется газообразный водород: 900 объёмов в одном объёме палладия при 80 °С. В одном объёме платины при 450 °С растворяется около 70 объёмов кислорода. Эти твёрдые растворы обладают повышенной каталитической активностью во многих окислительно-восстановительных процессах.
Образование твёрдых растворов высокомолекулярных соединений с жидкими пластификаторами имеет важное значение в химии полимеров. Например, в присутствии пластификаторов жёсткий поливинилхлорид, из которого делают оконные рамы и виниловый сайдинг, превращается в гораздо более гибкий материал, что позволяет изготавливать из него шланги, оболочку электрических кабелей и т. п.
Образование твёрдых растворов происходит при легировании металлов и их сплавов — добавлении в состав основного материала небольших количеств особых примесей для улучшения его физических и химических свойств: износостойкости, прочности, пластичности, коррозионной стойкости. Полупроводниковые материалы на основе твёрдых растворов незаменимы в производстве изделий электронной техники.
Пример газообразного раствора — это воздух, представляющий собой смесь газообразных кислорода, азота, углекислого газа и благородных газов, паров воды, в которой преобладает азот.
Примерами жидких растворов являются нефть — смесь жидких углеводородов, уксус — раствор уксусной кислоты в воде. Вода — самый распространённый растворитель. Главной причиной проявления водой свойств хорошего растворителя, в частности солей и молекулярных соединений с полярными связями, является строение её полярных молекул, представляющих собой диполи. Растворяющие свойства воды значительно усиливает её способность образовывать межмолекулярные водородные связи с полярными молекулами.
*Процесс растворения
Итак, жидкие и твёрдые растворы — это не механическая смесь частиц растворителя и растворённого вещества, а продукт физико-химических процессов, в результате которых исчезает межфазная граница и образуется гомогенная система.
По мере растворения вещества его концентрация в растворе повышается, а сам процесс замедляется. В насыщенном растворе избыток нерастворённого вещества находится в подвижном равновесии с раствором: скорость растворения частиц вещества равна скорости их возвращения из раствора обратно в исходную фазу (газ, жидкость или кристалл).
Между частицами растворённого вещества и растворителя имеет место электростатическое взаимодействие. Оно реализуется при растворении в воде электролитов — солей, щелочей и др., когда полярные молекулы воды связываются силами кулоновского притяжения с катионами и анионами электролита.
Межмолекулярное взаимодействие растворённого вещества и растворителя может происходить посредством образования водородных связей, например, между молекулами воды и спиртов, аминов, аммиака и др.
Взаимодействие молекул растворителя и частиц растворяемого вещества имеет определяющее значение. Так, гелий — это газ, состоящий из самых маленьких атомов, и одновременно наименее растворимый в воде газ. Следовательно, растворимость вещества — это не способность его частиц размещаться между молекулами воды (или иного растворителя), а способность с ними взаимодействовать.
Тепловые явления при растворении
Для разрыва химических связей между частицами растворяемого вещества необходимо затратить энергию. Следовательно, количество теплоты в системе убывает и первая стадия растворения — это эндотермический процесс. При связывании частиц растворяемого вещества и растворителя на второй стадии процесса растворения энергия, наоборот, выделяется. Это экзотермический процесс, количество теплоты возрастает. Суммарный тепловой эффект процесса растворения равен сумме двух величин:
Q(растворения) = –Q(разрыв химических связей) + Q(образование химических связей).
Экспериментальные данные показывают, что при растворении твёрдых веществ в одних случаях теплота выделяется, а в других — поглощается. Например, при растворении в воде нитрата аммония NH4NO3 наблюдается сильное охлаждение раствора. Причина заключается в том, что количество теплоты, выделяющейся при взаимодействии катионов и анионов
с молекулами воды, меньше количества теплоты, затрачиваемой на разрыв ионных связей в кристаллах нитрата аммония (Q(растворения) = –26,4 кДж/моль). Другой пример — растворение в воде гидроксида калия, которое сопровождается сильным разогреванием раствора. В этом случае энергия, выделяемая при взаимодействии ионов K+ и OH– с молекулами воды, больше, чем энергия, затрачиваемая на разрыв связей между этими ионами в кристаллическом KOH (Q(растворения) = +55,6 кДж/моль).
Растворение газов и жидкостей в воде обычно сопровождается выделением теплоты, так как практически отсутствуют затраты энергии на разрушение связей между молекулами исходного вещества.
Растворимость веществ в воде
Как правило, хорошо растворяются друг в друге подобные по физическим и химическим свойствам вещества, то есть действует эмпирическое правило «подобное растворяется в подобном». Например, вещества, состоящие из полярных молекул, и вещества с ионным типом химической связи хорошо растворяются в полярных растворителях (вода, этанол). Неполярные вещества хорошо растворяются в неполярных растворителях (бензол, толуол).
Нерастворимые газы (например, He, Ne, H2, N2, CO) имеют растворимость менее 2 см3/100 г воды. Нерастворимыми в воде являются многие твёрдые вещества: оксиды (например, CuO, ZnO, Fe2O3, Cr2O3, Al2O3, SiO2), приведённые в таблице растворимости со знаком Н, а также соли и основания. Нерастворимы в воде жидкие и твёрдые алканы и циклоалканы.
К малорастворимым в воде (в таблице растворимости отмечены М) относятся твёрдые вещества: Ca(OH)2, LiF, BaF2, MgCO3, Li3PO4, жидкие: бензол, толуол, CCl4, CHCl3, CH2Cl2, газы: Ar, Kr, Xe, O2, NO, N2O, газообразные алканы и алкены.
Растворимыми в воде веществами (в таблице растворимости отмечены Р) являются:
- твёрдые: моно- и дисахариды, все нитраты, ацетаты и формиаты; соли, образованные ионами
, K+, Na+, Rb+, Cs+; H3PO4; большинство аминокислот;
- жидкие: первые члены гомологических рядов спиртов, карбоновых кислот, сложных эфиров, аминов и альдегидов;
- газообразные: Cl2, галогеноводороды, SO2, H2S, CO2, HC≡CH, H2C=O (метаналь).
Растворяя вещество в воде, можно получить насыщенные и ненасыщенные растворы.
Насыщенным называют такой раствор, в котором при заданной температуре вещество больше не растворяется. Соответственно, в ненасыщенном растворе можно растворить дополнительное количество вещества.
Именно к насыщенным растворам относится количественная характеристика способности вещества к растворению, или растворимость. Растворимость измеряют, определяя содержание растворённого вещества в его насыщенном растворе при заданной температуре.
Наиболее часто используют численную характеристику — растворимость (s). Растворимость численно равна максимальной массе вещества, способного при данной температуре раствориться в 100 г растворителя. Так, s10(KNO3) равна 21 г/100 г воды при 10 °С.
Растворимость газа определяют как максимальный объём газа (V, см3), растворяющегося в 100 г растворителя при заданных температуре и давлении. Часто используют такую единицу измерения, как количество объёмов растворённого газа на один объём воды.
Растворимость нередко измеряют и в других величинах, указывая массовую долю или молярную концентрацию растворённого вещества в насыщенном растворе. Эти же величины применяют для количественного выражения состава ненасыщенных растворов. К этим величинам вы обратитесь, изучая материал следующего параграфа.
Как вам уже известно, вещества по растворимости в воде условно делят на три группы (см. второй форзац). Вещество считают растворимым, если при 20 °С растворяется более 1 г вещества в 100 г воды или 100 см3 в 100 г воды в случае газов. Вещество малорастворимо, если его растворимость находится в пределах от 0,01 до 1 г в 100 г воды, и практически нерастворимо при растворимости менее 0,01 г в 100 г воды.
Концентрированные растворы содержат много растворённого вещества, а в разбавленных растворах концентрация растворённого вещества мала. Деление растворов на концентрированные и разбавленные условно. Оно не связано с делением на насыщенные и ненасыщенные растворы. Например, насыщенный раствор BaSO4 содержит 0,0002448 г соли на 100 г воды при 20 °С. Значит, это очень разбавленный раствор. Насыщенный раствор KOH содержит 112 г/100 г воды. Если растворить 80 г KOH в 100 г воды, то получим концентрированный, но ненасыщенный раствор.
Растворимость твёрдых и жидких веществ зависит от их природы и температуры раствора. С увеличением температуры растворимость большинства твёрдых веществ и жидкостей заметно возрастает (рис. 51). При охлаждении, соответственно, растворимость уменьшается и часть вещества выпадает в виде осадка — кристаллизуется.

Кристаллизация играет огромную роль в природе: она приводит к образованию многих минералов, например галита (NaCl), сильвина (KCl), сталактитов и сталагмитов (СаСО3). В промышленности методом кристаллизации выращивают крупные кристаллы NaCl, LiF для оптических приборов, кристаллы SiO2 для ультразвуковых генераторов, микрофонов и др.
Растворимость газов в воде зависит от их природы, температуры и давления (рис. 52, 53).

газообразных веществ в воде
от температуры

углекислого газа в воде от давления
При растворении газов выделяется теплота. При повышении температуры их растворимость понижается. При увеличении давления растворимость газа повышается. Поэтому, указывая растворимость газа в воде при заданной температуре, имеют в виду растворимость при его давлении 1 атм или 101,325 кПа.
Некоторые жидкости, такие как H2SO4, HNO3, HF (tкип. = 19,5 °C), CH3COOH, HCOOH, CH3OH, C2H5OH, этиленгликоль, глицерин, ацетон, смешиваются с водой в любых соотношениях, поэтому говорят об их неограниченной растворимости.

По кривым растворимости, примеры которых представлены на рисунках 51−53, можно провести различные расчёты. Так, можно определить массу вещества, которое выпадает в осадок из насыщенного раствора при его охлаждении. Например, по кривой растворимости видно, что если приготовить насыщенный при 70 °C раствор нитрата калия в 100 г воды, а затем охладить этот раствор до 30 °С, то из него выпадет соль массой 140 – 50 = 90 г.
Повторная кристаллизация соединений из их насыщенного раствора путём его охлаждения или упаривания части растворителя называется перекристаллизацией и лежит в основе метода очистки твёрдых веществ. В процессе перекристаллизации растворимые примеси обычно остаются в растворе и в осадок не выпадают, поскольку образуют ненасыщенный раствор.
Если в насыщенный раствор вещества поместить его маленький кристаллик, то по мере испарения растворителя на поверхности этого кристаллика будет осаждаться растворённое вещество и образуется большой однородный кристалл (рис. 53.1).
Гидраты и кристаллогидраты
В ряде случаев в результате физико-химического взаимодействия частиц растворённого вещества с водой образуются соединения — гидраты. Такой процесс называют гидратацией. Молекулы воды при этом не разрушаются, а связываются с молекулами или ионами растворённого вещества.
Гидраты — это продукты присоединения воды к неорганическим и органическим веществам, в которых молекула воды присутствует в виде отдельной структурной единицы.
Многие гидраты легко распадаются, хотя могут образовывать и устойчивые соединения. В ряде случаев после упаривания растворителя и кристаллизации растворённого соединения можно выделить кристаллогидраты.
Большинство кристаллогидратов являются солями. Кристаллогидраты образуются, если в кристаллической решётке катионы связываются с молекулами воды более прочно, чем с анионами в кристаллах безводной соли. Состав кристаллогидрата выражают формулой, указывающей число молекул кристаллизационной воды на одну структурную единицу вещества, например кристаллическая сода Na2CO3 · 10H2O, гипс CaSO4 · 2H2O, медный купорос CuSO4 · 5H2O. С этими кристаллогидратами вы уже знакомы из курсов химии 8-го и 9-го классов.
Иногда кристаллогидраты образуют кислоты (щавелевая, лимонная), основания (KOH · 2H2O, NaOH · H2O, Ba(OH)2 · 8H2O), а также некоторые углеводы (глюкоза) и их производные (сорбит).
Кристаллогидраты — это кристаллические продукты присоединения воды к неорганическим и органическим веществам, имеющие определённый состав и включающие молекулы воды в виде отдельной структурной единицы. Вода, входящая в состав кристаллогидратов, называется кристаллизационной.
Многие кристаллогидраты ярко окрашены. Например, безводный CoCl2 имеет синий цвет. В результате гидратации он превращается в тёмно-розовый кристаллогидрат CoCl2 · 6H2O (рис. 54, а) и поэтому может использоваться в качестве индикатора присутствия воды. Аналогичную роль может играть и сульфат меди(II): безводный CuSO4 — бледно-голубой, кристаллогидрат CuSO4 · 5H2O — ярко-синий (рис. 54, б).

Процесс образования кристаллогидратов используется в строительстве. Так, порошок цемента в основном состоит из смеси безводных кристаллов 3CaO · SiO2 и 2CaO · SiO2. При смешивании цемента с водой протекают процессы гидратации и образования кристаллогидратов 3CaO · SiO2 · 3H2O и 2CaO · SiO2 · 3H2O. При этом пластичный цементный клей, напоминающий по консистенции тесто, затвердевает и превращается в цементный камень.
Молекулы воды в гидратах связываются с молекулами или ионами растворённого вещества за счёт донорно-акцепторного, электростатического взаимодействия или образования водородных связей.
В гидратах молекулы или ионы растворённого вещества оказываются окружёнными более или менее тесно связанными с ними молекулами воды, число которых может меняться.
Гидратную теорию растворов предложил Д. И. Менделеев. Он писал: «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворённым телом».
Тот факт, что образование растворов в значительной степени является химическим взаимодействием, подтверждается не только выделением или поглощением теплоты при растворении, но и уменьшением объёма раствора в сравнении с исходным суммарным объёмом его компонентов. Например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Раствор при этом немного нагревается.
В таблице 15.1 приведены примеры наиболее распространённых кристаллогидратов.
Таблица 15.1. Формулы, внешний вид и названия кристаллогидратов
| Название кристаллогидрата | Химическая формула | Внешний вид |
|---|---|---|
| Кристаллическая сода, декагидрат карбоната натрия | Na2CO3 · 10H2O |
 |
| Медный купорос, пентагидрат сульфата меди(II) | CuSO4 · 5H2O |
 |
| Железный купорос, гептагидрат сульфата железа(II) | FeSO4 · 7H2O |
 |
| Цинковый купорос, гептагидрат сульфата цинка(II) | ZnSO4 · 7H2O |
 |
| Глауберова соль, декагидрат сульфата натрия | Na2SO4 · 10H2O |
 |
| Гипс, дигидрат сульфата кальция | CaSO4 · 2H2O |
 |
Растворы — гомогенные устойчивые системы переменного состава, состоящие из нескольких компонентов.
Растворение — это физико-химический процесс, сопровождающийся выделением или поглощением теплоты.
Растворимость веществ зависит от их природы и температуры. На растворимость газов влияет давление.
Кристаллогидраты — это кристаллические продукты присоединения воды к неорганическим и органическим веществам, имеющие определённый состав и включающие молекулы воды в виде отдельной структурной единицы.
Вопросы, задания, задачи
1. Приведите примеры твёрдых, жидких и газообразных растворов. Укажите области применения твёрдых растворов.
2. Укажите основные различия между раствором и механической смесью веществ.
3. Пользуясь данными таблицы растворимости на форзаце учебника, приведите по два примера:
- а) растворимых;
- б) малорастворимых;
- в) практически нерастворимых в воде соединений.
Запишите их формулы.
4. Даны соединения: хлороводород, нитрат калия, хлорид калия, хлорид натрия, оксид серы(IV), аммиак. С помощью кривых растворимости (рис. 51), а также знаний о растворимости газов определите вещества, растворимость которых в воде при повышении температуры:
- а) возрастает;
- б) практически неизменна;
- в) уменьшается.
5. Назовите процессы взаимодействия между молекулами воды и растворяемым веществом при образовании водного раствора.
6. По кривым растворимости (рис. 51) найдите растворимость солей: нитрата натрия, хлорида аммония и хлорида натрия при 20 °С, 50 °С, 70 °С.
7. Растворимость натриевой селитры NaNO3 при 10 °С равна 80 г на 100 г воды. Определите массовую долю соли в насыщенном растворе при этой температуре.
8. Массовая доля KNO3 в насыщенном при 20 °С растворе равна 24,0 %. Определите растворимость KNO3 при 20 °С (г/100 г воды).
9. Рассчитайте, на сколько граммов различается масса 500 г безводного сульфата кальция и его двухводного кристаллогидрата (гипса).
10. Растворимость аммиака при 0 °С равна 1153 объёма на 1 объём воды, а при 30 °С — 532 объёма (при н. у.) на 1 объём воды. Насыщенный при 0 °С раствор массой 250 г нагрели до 30 °С. Как изменилась его масса? Какой объём (при н. у.) аммиака выделился при нагревании? Ответ подтвердите расчётом.
*Самоконтроль
1. Процесс растворения NaCl в воде сопровождается:
- а) равномерным распределением частиц соли в воде;
- б) химической реакцией между растворённым веществом и растворителем;
- в) взаимодействием частиц растворённого вещества с молекулами растворителя с образованием гидратов;
- г) разрушением кристаллической структуры соли.
2. Декагидрату сульфата натрия соответствует формула:
- а) Na2SO4;
- б) NaHSO4;
- в) Na2SO4 ∙ 10H2O;
- г) Na2SO4 ∙ 7H2O.
3. К раствору относятся системы:
- а) Н2О — мел;
- б) Н2О — сода;
- в) H2O — углекислый газ;
- г) CaSO4 ∙ 2H2O.
4. Растворимость газа в воде можно увеличить:
- а) повышая температуру растворителя;
- б) повышая давление газа;
- в) перемешивая раствор;
- г) понижая температуру растворителя.
5. Растворимость нитрата калия s10(KNO3) = 60 г/100 г воды. Его раствор с массовой долей 0,375 является:
- а) насыщенным;
- б) разбавленным;
- в) концентрированным;
- г) ненасыщенным.