§ 20. Скорость химических реакций

реакции: а — превращение древесины
в каменный уголь, б — ржавление железа,
в — горение бумаги
Одни химические реакции протекают быстро, другие — медленно. Так, процесс превращения древесины в каменный уголь длится сотни миллионов лет (рис. 47, а). Ржавление изделий из железа под действием влажного воздуха идёт многие годы (рис. 47, б). Горение на воздухе бумаги (целлюлозы) происходит за секунды (рис. 47, в). Практически мгновенно идёт реакция нейтрализации щёлочи сильной кислотой.
Следовательно, химические реакции имеют разную скорость. Скорость химической реакции показывает изменение концентрации вступающего в реакцию или образующегося в ней вещества в единицу времени. Это физическая величина, обозначается буквой .
Скорость реакций по мере их протекания изменяется. Поэтому обычно говорят о средней скорости реакции в определённый промежуток времени.
Для количественного определения скорости в качестве примера рассмотрим гомогенную химическую реакцию окисления оксида азота(II) кислородом до оксида азота(IV):
2NO + O2 = 2NO2.
В промежуток времени Δt = t2 – t1 количества (моль) исходных веществ (реагентов) n(NO) и n(O2) уменьшаются, а количество продукта реакции n(NO2) увеличивается. Мы знаем, что величина отношения количества n вещества X к объёму реакционной смеси V называется молярной концентрацией с(X):
, причём
.
Таким образом, в реакционной смеси определённого объёма V изменение количеств (моль) участников реакции пропорционально изменению их молярных концентраций Δс.
Для определения величины скорости реакции υ необходимо знать изменение количества (моль) Δn = n2 – n1 одного из веществ (NO, O2 или NO2), произошедшее в промежуток времени Δt = t2 – t1, и объём реакционной смеси V.
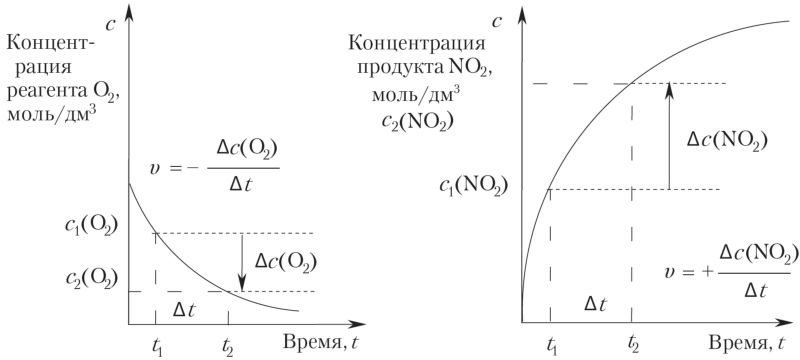
Математическое выражение скорости реакции по отношению к любому заданному участнику X можно представить следующим образом:
где Δc(X) — изменение молярной концентрации вещества X за время Δt.
Так как скорость реакции является положительной величиной, а концентрация реагентов NO и O2 уменьшается, то в выражение скорости для исходных веществ ставят знак «минус». Концентрация продуктов возрастает, следовательно, в выражение ставят знак «плюс».
Если коэффициенты в уравнении химической реакции не равны единице, то скорость, измеренная для разных веществ, различается.

Скорость реакции определяется химической природой реагирующих веществ.
Вещества, вступающие в химические реакции, различаются составом и строением, типом химической связи, числом и прочностью этих связей. Как следствие, реагенты обладают разной реакционной способностью. Рассмотрим в качестве примера скорость взаимодействия разных металлов с сильной и слабой кислотами.
Если опустить в пробирки с разбавленной соляной кислотой кусочки магния и железа одинакового размера и формы, то можно увидеть, что в пробирке с магнием наблюдается бурное выделение водорода и сильное разогревание. В пробирке с железом пузырьки газа выделяются гораздо медленнее, а температура поднимается лишь немного. Следовательно, скорость взаимодействия металла с кислотой зависит от его активности.
При замене сильной хлороводородной кислоты на слабую уксусную кислоту той же молярной концентрации скорость реакции магния и железа существенно уменьшается. Итак, скорость взаимодействия металла с кислотой зависит от природы обоих реагентов — как металла, так и кислоты.

Для протекания химической реакции необходимо, чтобы реагирующие частицы столкнулись друг с другом. Однако этого условия недостаточно, так как при столкновении необязательно произойдёт реакция. Так, при атмосферном давлении и комнатной температуре каждая молекула в различных газах (N2, O2, Ar и др.) испытывает около 5 млрд столкновений ежесекундно. Если бы все столкновения частиц приводили к химической реакции, то любое химическое превращение завершалось бы за тысячные доли секунды. Раз этого не происходит, значит, не все столкновения эффективны. Для того чтобы химическое превращение произошло, частицам необходимо обладать энергией, достаточной для разрушения или перестройки химических связей в исходных веществах.
В процессе химического взаимодействия молекулы должны пройти через особое переходное состояние, в котором они особенно активны. Для достижения такого состояния требуется затратить энергию.
Энергия активации — это минимальная энергия, которую необходимо сообщить частицам реагирующих веществ для перевода в активное состояние, обеспечивающее протекание химической реакции при их столкновении (рис. 48).
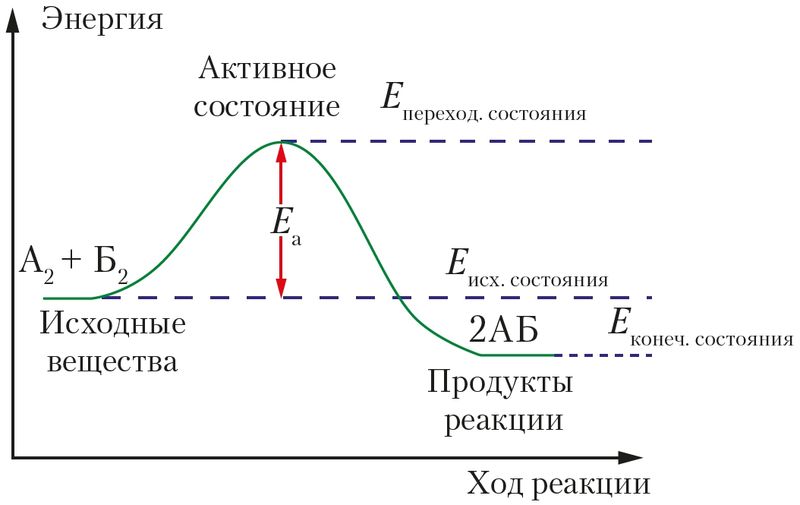
При одинаковой температуре скорости химических реакций сильно различаются в основном из-за величины энергии активации, обозначаемой Еа (кДж/моль). Чем меньше величина Ea, тем более низкий «энергетический барьер» требуется преодолеть реагентам и тем больше скорость реакции.
В ряде случаев для инициирования экзотермических реакций реагенты необходимо вначале разогреть, чтобы перевести реагирующие вещества в активное состояние. Например, спичка вспыхнет при трении, а газовая горелка зажжётся от горящей спички.
