§ 17. Межмолекулярное взаимодействие и водородная связь
Вопросы, задания, задачи
1. Опишите образование водородных связей на примере:
- а) воды;
- б) фтороводорода:
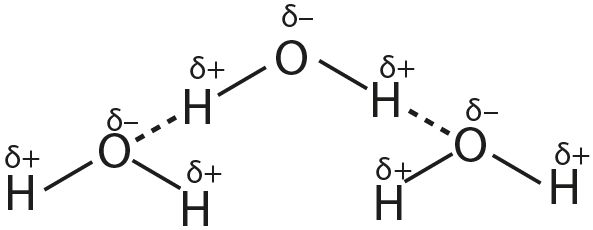
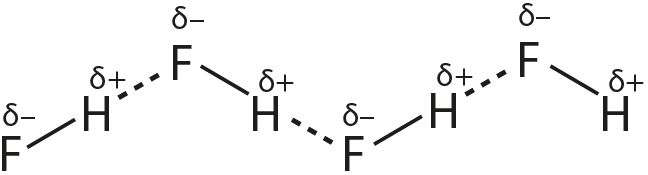
2. Приведите примеры веществ, при растворении которых в воде образуются водородные связи между молекулами воды и этого вещества.
3. Учитывая, что образование водородных связей характерно для молекул веществ, содержащих группы ОН, объясните малую летучесть и сравнительно высокую вязкость серной и фосфорной кислот.
4. Расположите следующие молекулы в порядке увеличения сил межмолекулярного взаимодействия: Н2, He, F2, Br2, H2O. Сравните эти вещества по температурам кипения.
5. Укажите вещества, для которых возможно существование:
- а) межмолекулярной водородной связи — фтороводород, метан, уксусная кислота, пропанол-1, пропан;
- б) внутримолекулярной водородной связи — этиленгликоль, этанол, этан, полипептид, целлюлоза.
6. Объясните, почему температура кипения аммиака выше, чем температура кипения фосфина.
7. Объясните характер зависимости температуры кипения водородного соединения ЭHx от порядкового номера р-элемента Э, используя данные рисунка 44.
8. Почему молекулярные кристаллические вещества, в отличие от ионных, после плавления практически не проводят электрический ток?
9. Рассчитайте количество вещества в бруске льда объёмом 1 дм3. Плотность льда — 0,917 г/см3.
10. Определите простейшую формулу вещества и изобразите схему образования водородных связей между молекулами вещества, в котором массовая доля углерода — 0,375, водорода — 0,125, кислорода — 0,500.