§ 16. Типы кристаллических структур
Зависимость свойств веществ от типа кристаллической структуры
Свойства твёрдых веществ зависят от строения кристаллов и прочности в них химических связей. Например, углерод образует несколько разновидностей кристаллических структур. Одна из них — структура алмаза, в которой каждый атом углерода образует четыре равные по прочности ковалентные связи с четырьмя соседними атомами углерода, расположенными в вершинах тетраэдра (рис. 38). Благодаря своему строению алмаз — самое твёрдое природное вещество (Приложение 2). Аналогичные кристаллические структуры и близкую к алмазу твёрдость имеют карборунд SiC и боразон BN.
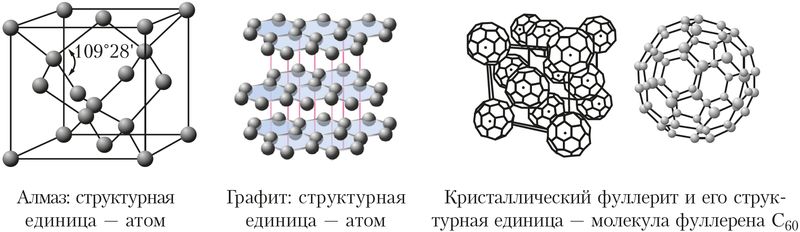
Другая разновидность кристаллического углерода — графит. В графите атомы углерода расположены слоями. В слоях каждый атом углерода использует три своих электрона для образования трёх ковалентных связей с соседними атомами. Четвёртый электрон участвует в образовании делокализованных π-связей и может свободно перемещаться вдоль слоя. Поэтому графит обладает электропроводностью и используется для изготовления электроконтактов, проводящих смазок, электродов и др.
Расстояние между слоями графита значительно больше, чем между атомами в слое. Поэтому графит легко расслаивается. Благодаря этому свойству из графита изготавливают грифели карандашей, он входит в состав различных смазок, снижающих трение, и сам является твёрдой смазкой в формах для литья металлов.
Третья кристаллическая модификация углерода — фуллерит — образована молекулами фуллерена С60, состоящими из 60 атомов углерода.
Атомные, ионные и металлические кристаллы различаются устойчивостью к механической деформации, в результате которой происходит смещение отдельных слоёв кристаллической структуры (рис. 39). При этом сцепление между слоями в атомных кристаллах (а) нарушается из-за разрыва химических связей между атомами, а в ионных — из-за отталкивания одноимённо заряженных ионов (б). В металлических кристаллах благодаря особенностям металлической связи кристаллы не разрушаются, а деформируются. Поэтому металлы пластичны (ковки), а атомные и ионные кристаллы — хрупки.
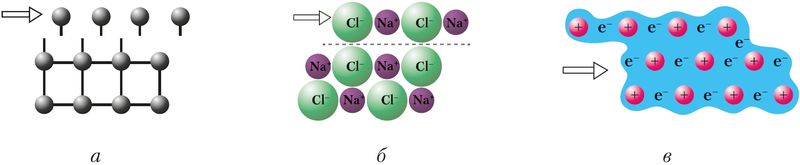
а — атомных, б — ионных, в — металлических