§ 15. Валентность и степень окисления
Валентность
Способность атомов присоединять к себе строго определённое число других атомов характеризуется с помощью валентности.
Наиболее просто объяснить, что такое валентность, можно на примере соединений с ковалентными связями. В таких соединениях валентность атомов отдельного элемента принято определять числом образованных ковалентных связей.
Например, валентность кислорода в молекулах воды , пероксида водорода
, метаналя
![]() равна двум.
равна двум.
Валентность азота в простом веществе и аммиаке
![]() равна трём, а в ионе аммония — четырём:
равна трём, а в ионе аммония — четырём: 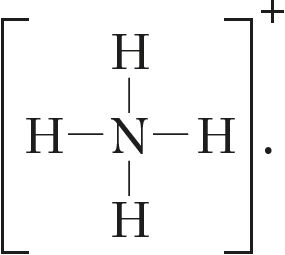
Прогнозируя число возможных валентностей атома какого-либо элемента в различных соединениях, мы указываем валентные возможности атома. Валентные возможности атома определяются:
- а) числом неспаренных валентных электронов, способных принять участие в образовании химических связей по обменному механизму;
- б) числом внешних атомных орбиталей (вакантных или заполненных), способных образовать химическую связь по донорно-акцепторному механизму.
Рассмотрим валентные возможности атома фосфора с учётом числа его неспаренных электронов. Электронная конфигурация валентного слоя атома фосфора в основном состоянии — 3s23p33d0, что даёт ему возможность образовать только три связи по обменному механизму: 15P ![]()
Но атом фосфора способен образовать и пять связей, если один 3s-электрон перевести в возбуждённое состояние. При этом электронная конфигурация атома фосфора будет иметь вид 3s13p33d1:
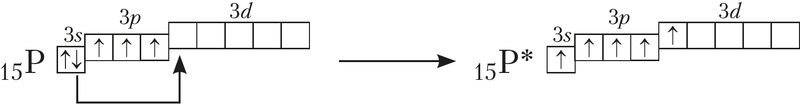
Применяя аналогичные построения, можно прийти к заключению, что атом серы может проявлять валентности 2, 4, 6, а атом хлора — 1, 3, 5, 7.
Рассмотрим валентные возможности азота, атомы которого, как и атомы фосфора, имеют пять электронов на внешнем электронном уровне. Исходя из электронной конфигурации его валентного слоя 2s22p3 и электронно-графической схемы ![]() , делаем заключение, что атомы азота могут проявлять валентность 3, так как имеют три неспаренных электрона. Пятивалентное состояние для него невозможно из-за отсутствия свободных орбиталей на втором уровне. Однако у атома азота на внешнем уровне имеются четыре орбитали (ячейки). Поэтому он может образовать четыре ковалентные связи, что мы наблюдаем в случае иона аммония:
, делаем заключение, что атомы азота могут проявлять валентность 3, так как имеют три неспаренных электрона. Пятивалентное состояние для него невозможно из-за отсутствия свободных орбиталей на втором уровне. Однако у атома азота на внешнем уровне имеются четыре орбитали (ячейки). Поэтому он может образовать четыре ковалентные связи, что мы наблюдаем в случае иона аммония:
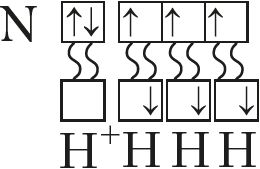
Таким образом, максимальная валентность атомов азота равна 4.
Максимальная валентность не только азота, но и других элементов второго периода не может превышать четырёх, так как на внешней электронной оболочке атомов этих элементов имеются только четыре орбитали.
Почему нельзя расширить валентные возможности элементов второго периода, предоставив электронам возможность перейти на 3-й энергетический уровень? Это объясняется тем, что разница в энергии между 2-м и 3-м энергетическими уровнями гораздо больше, чем между подуровнями одного энергетического уровня, и затраты энергии на возбуждение не компенсируются энергией образования новых связей.