§ 15. Валентность и степень окисления
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 15. Валентность и степень окисления |
| Напечатано:: | Гость |
| Дата: | Пятница, 23 Май 2025, 06:44 |
Валентность
Способность атомов присоединять к себе строго определённое число других атомов характеризуется с помощью валентности.
Наиболее просто объяснить, что такое валентность, можно на примере соединений с ковалентными связями. В таких соединениях валентность атомов отдельного элемента принято определять числом образованных ковалентных связей.
Например, валентность кислорода в молекулах воды , пероксида водорода
, метаналя
![]() равна двум.
равна двум.
Валентность азота в простом веществе и аммиаке
![]() равна трём, а в ионе аммония — четырём:
равна трём, а в ионе аммония — четырём: 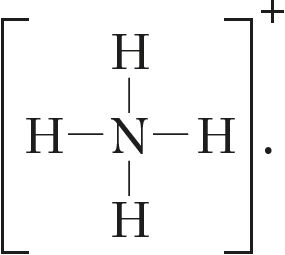
Прогнозируя число возможных валентностей атома какого-либо элемента в различных соединениях, мы указываем валентные возможности атома. Валентные возможности атома определяются:
- а) числом неспаренных валентных электронов, способных принять участие в образовании химических связей по обменному механизму;
- б) числом внешних атомных орбиталей (вакантных или заполненных), способных образовать химическую связь по донорно-акцепторному механизму.
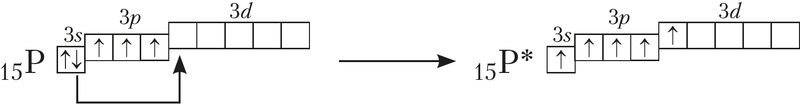
Рассмотрим валентные возможности атома фосфора с учётом числа его неспаренных электронов. Электронная конфигурация валентного слоя атома фосфора в основном состоянии — 3s23p33d0, что даёт ему возможность образовать только три связи по обменному механизму: 15P ![]()
Но атом фосфора способен образовать и пять связей, если один 3s-электрон перевести в возбуждённое состояние. При этом электронная конфигурация атома фосфора будет иметь вид 3s13p33d1:
Применяя аналогичные построения, можно прийти к заключению, что атом серы может проявлять валентности 2, 4, 6, а атом хлора — 1, 3, 5, 7.
Рассмотрим валентные возможности азота, атомы которого, как и атомы фосфора, имеют пять электронов на внешнем электронном уровне. Исходя из электронной конфигурации его валентного слоя 2s22p3 и электронно-графической схемы ![]() , делаем заключение, что атомы азота могут проявлять валентность 3, так как имеют три неспаренных электрона. Пятивалентное состояние для него невозможно из-за отсутствия свободных орбиталей на втором уровне. Однако у атома азота на внешнем уровне имеются четыре орбитали (ячейки). Поэтому он может образовать четыре ковалентные связи, что мы наблюдаем в случае иона аммония:
, делаем заключение, что атомы азота могут проявлять валентность 3, так как имеют три неспаренных электрона. Пятивалентное состояние для него невозможно из-за отсутствия свободных орбиталей на втором уровне. Однако у атома азота на внешнем уровне имеются четыре орбитали (ячейки). Поэтому он может образовать четыре ковалентные связи, что мы наблюдаем в случае иона аммония:
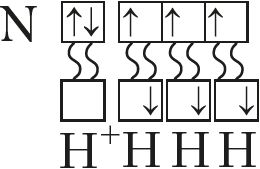
Таким образом, максимальная валентность атомов азота равна 4.
Максимальная валентность не только азота, но и других элементов второго периода не может превышать четырёх, так как на внешней электронной оболочке атомов этих элементов имеются только четыре орбитали.
Почему нельзя расширить валентные возможности элементов второго периода, предоставив электронам возможность перейти на 3-й энергетический уровень? Это объясняется тем, что разница в энергии между 2-м и 3-м энергетическими уровнями гораздо больше, чем между подуровнями одного энергетического уровня, и затраты энергии на возбуждение не компенсируются энергией образования новых связей.
Степень окисления
В случае веществ с ионными или полярными связями для характеристики состояния атомов, образующих эти связи, используют понятие степень окисления. Как вы уже знаете из материала параграфа § 11, степень окисления атома — это условный заряд, который приписывают атому в предположении, что он образует с соседними атомами только ионные связи.
Численное значение степени окисления атома в конкретном соединении определяют по количеству электронов, смещённых при образовании связи или переданных соседним атомам. Так, cтепень окисления атомов азота в молекулах простого вещества ![]() равна 0 (электроны не смещены, связь ковалентная неполярная). В молекуле аммиака азот проявляет степень окисления –3, так как к атому азота сместились три электрона от атомов водорода. Атомы водорода при этом имеют степень окисления +1.
равна 0 (электроны не смещены, связь ковалентная неполярная). В молекуле аммиака азот проявляет степень окисления –3, так как к атому азота сместились три электрона от атомов водорода. Атомы водорода при этом имеют степень окисления +1.
При вычислениях учитывают, что алгебраическая сумма степеней окисления всех атомов в соединении равна 0.
Не следует забывать, что атомы некоторых элементов имеют постоянное значение степени окисления в своих соединениях (,
,
,
и др.). Наиболее электроотрицательные атомы в конкретном соединении обычно имеют низшую степень окисления.
Так, в молекуле CF4 более электроотрицателен фтор, его атомы имеют степень окисления –1. Следовательно, углерод находится в степени окисления +4, то есть .
В перманганате калия KMnO4 калий имеет постоянную степень окисления, кислород как наиболее электроотрицательный элемент находится в низшей степени окисления –2, поэтому степень окисления марганца можно найти из равенства 0 = (+1) + х + 4(–2), то есть .
Во многих ковалентных соединениях абсолютная величина степени окисления элементов равна их валентности. Например, азот в молекуле аммиака имеет валентность 3 и степень окисления –3. В случае ионных соединений атомов металлов с р-элементами V–VII-групп используют понятие «степень окисления». Например, в хлориде кальция СаCl2 степень окисления хлора –1, а кальция — +2.
Валентность может отличаться от степени окисления. Это характерно, например, для простых веществ, в молекулах которых степень окисления атомов всегда равна нулю, а валентность — числу общих электронных пар.
Так, в молекуле кислорода валентность кислорода равна 2, а степень окисления 0. В качестве другого примера приведём молекулу пероксида водорода
. В ней кислород двухвалентен, а водород одновалентен. В то же время степени окисления обоих элементов по абсолютной величине равны 1:
. Не совпадают значения степени окисления и валентности азота в ионе аммония (–3, 4)
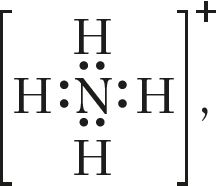 молекуле азотной кислоты (+5, 4)
молекуле азотной кислоты (+5, 4) .
Степень окисления атомов определяет характер возможных химических взаимодействий с участием этих атомов. Так, элемент в низшей степени окисления (в данном случае азот в степени окисления –3) может выступать только как восстановитель:
Элемент в высшей степени окисления (азот, +5) может быть только окислителем:
В промежуточной степени окисления элемент (азот, +2) может быть как окислителем, так и восстановителем:
(азот — восстановитель, окисляется);
(азот — окислитель, восстанавливается).
Высшая степень окисления атомов А-групп равна номеру группы (за исключением благородных газов, фтора и кислорода). Низшая, отрицательная, степень окисления равна номеру А-группы минус 8.
Валентность — это способность атомов данного элемента присоединять к себе определённое число других атомов.
Валентные возможности атома определяются как числом его неспаренных электронов в основном или возбуждённом состоянии, способных принять участие в образовании химических связей по обменному механизму, так и числом атомных орбиталей (вакантных или заполненных) на внешнем слое, участвующих в образовании химической связи по донорно-акцепторному механизму.
Степень окисления атома — это условный заряд, который приписывают атому в предположении, что он образует с соседними атомами только ионные связи.
Вопросы, задания, задачи
1. Определите валентности атомов углерода и кислорода в соединении, электронная формула которого ![]() . Составьте его структурную и молекулярную формулы.
. Составьте его структурную и молекулярную формулы.
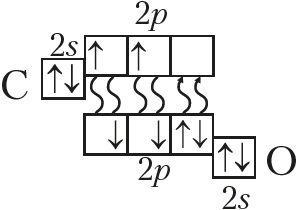
2. По электронно-графической формуле составьте структурную, электронную и молекулярную формулы вещества. Определите степени окисления и валентность каждого из атомов. Назовите соединение.
3. Назовите значения высшей степени окисления атомов кислорода и серы. Почему их значения не совпадают?
4. Изобразите с помощью электронно-графических схем и формул электронных конфигураций основное и возбуждённое состояния атомов S и Сl. Укажите число неспаренных электронов в каждом случае. Почему атомы хлора чаще всего проявляют нечётные степени окисления, а атомы серы — чётные?
5. Составьте формулы бинарных соединений, используя значения степеней окисления атомов (табл. 7): нитрид бора, карбид алюминия, фосфид кальция, силицид магния, гидрид натрия, бромид железа(III), оксид азота(III).
6. Определите степени окисления атомов в ионах ,
,
,
, а также солях Na3РО4, Na2SO4, NaClO3, NH4Cl. Проанализируйте полученные результаты.
7. Сравните степени окисления атомов в каждой паре веществ и сделайте вывод — существует ли соответствие между оксидом и кислотой:
- а) N2О5 и НNO2;
- б) SO3 и H2SO4;
- в) Сl2O7 и HClO4;
- г) SO2 и H2SO4.
8. Составьте структурные формулы, укажите степени окисления каждого атома, покажите стрелками смещение электронной плотности:
| a) |
б) |
в) |
г) |
д) |
9. Определите валентность и степени окисления всех атомов в соединениях:
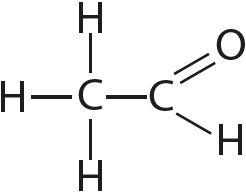
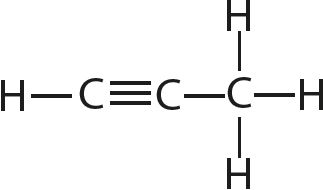
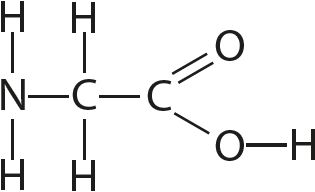
10. Определите степень окисления марганца в соединении KxMnyOz, в котором массовые доли калия, марганца и кислорода соответственно равны 0,396, 0,279 и 0,325.
*Самоконтроль
1. Металлы с постоянной степенью окисления входят в состав соединений:
- а) FeCl3;
- б) NaClO3;
- в) K2SO4;
- г) Li2O.
2. Максимальная валентность не может быть выше четырёх у атома:
- а) Р;
- б) Cl;
- в) S;
- г) N.
3. Валентность и модуль степени окисления углерода не совпадает в соединениях:
- а)

- б)
;
- в)
;
- г)
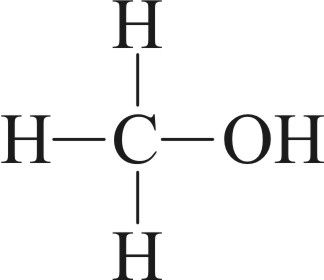 .
.
4. Азот может выступать только в качестве восстановителя в составе веществ:
- а) N2;
- б) NH3;
- в) NH4Cl;
- г) HNO3.
5. Увеличение степени окисления хрома наблюдается в ряду:
- а) CrCl2, Cr2O3, CrO;
- б) K2Cr2O7, K2CrO4, CrCl3;
- в) CrSO4, CrCl3, H2CrO4;
- г) CrO3, Cr2(SO4)3, CrCl2.