§ 3.1. Оксиды
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 3.1. Оксиды |
| Напечатано:: | Гость |
| Дата: | Понедельник, 18 Август 2025, 17:30 |
Номенклатура и классификация оксидов
Оксидами называют сложные вещества, состоящие из двух элементов, один из которых — кислород (ЭхОу). Кислород в оксидах проявляет степень окисления –2:
В обычных условиях оксиды могут быть в газообразном (CO2, NO), жидком (H2O) и чаще всего в твёрдом состоянии (рис. 6.2).

Соединение OF2 относят к фторидам, так как в данном соединении фтор — более электроотрицательный элемент, а степень окисления кислорода +2: .
Помимо оксидов, существует несколько групп бинарных кислородсодержащих веществ — пероксиды (Н2О2, Na2O2), надпероксиды (KO2, RbO2, CsO2) и озониды (KO3, CsO3). Атомы кислорода в них соединены между собой ковалентной связью. Степень окисления кислорода в них различная: –1, . Все эти вещества являются сильными окислителями.
Названия оксидов состоят из слова «оксид» и названия элемента, например: Li2O — оксид лития. Напомним, что в случае существования атомов элемента в нескольких положительных степенях окисления эту степень в названиях или формулах оксидов, оснований, солей указывают римскими цифрами. Их ставят в скобках после названия соответствующего элемента, например: оксид железа(III), гидроксид железа(II), хлорид железа(II).
Cуществуют оксиды, в которых атомы металла находятся в разных степенях окисления, например оксид железа(II, III) Fe3O4, или FeO ∙ Fe2O3.
Различают солеобразующие (основные, амфотерные, кислотные) и несолеобразующие оксиды.

К кислотным относят оксиды, которые соответствуют кислотам: ,
. Это, как правило, оксиды неметаллов (например,
), оксиды металлов с высокими значениями степени окисления +5, +6, +7 (например,
).
Кислотные оксиды часто называют ангидридами кислот (например, P2O5 — фосфорный ангидрид).
Оксиды, которым соответствуют основания, называют основными: K2O — KОН, ВаО — Ва(ОН)2. К ним относятся исключительно оксиды металлов.
Амфотерные оксиды (Al2O3, Cr2O3, ZnO, BeO) в зависимости от условий могут проявлять свойства как кислотных, так и основных оксидов.
Химические свойства оксидов
Химические свойства солеобразующих оксидов представлены в таблице 1.1.
Таблица 1.1. Химические свойства солеобразующих оксидов
| Основные (Na2O, СаО, MgO, FeO — оксиды металлов) |
Амфотерные (Al2O3, Cr2O3, ZnO, BeO — оксиды металлов) |
Кислотные (SO3, CO2, P2O5, CrO3 — оксиды и металлов, и неметаллов) |
| Реагируют: | ||
| с водой: | ||
|
Оксиды щелочных и щёлочно-земельных металлов: CaO + H2O = Ca(OH)2 |
— |
(Кроме SiO2): SO3 + H2O = H2SO4 |
| с кислотами: | ||
|
|
|
— |
| cо щелочами: | ||
| — |
|
|
| с кислотными оксидами: | ||
|
|
|
— |
| c основными оксидами: | ||
| — |
|
|
| c амфотерными оксидами: | ||
|
|
|
|
К несолеобразующим оксидам относится небольшое число оксидов неметаллов с низкими значениями степени окисления: . При комнатной температуре они не образуют соли ни с кислотами, ни со щелочами. Однако для них характерны реакции с изменением степени окисления элемента, образующего оксид.

Окислительно-восстановительные свойства могут проявлять не только несолеобразующие, но также основные, кислотные и амфотерные оксиды. В качестве примеров приведём некоторые практически значимые превращения оксидов:
(промежуточная стадия производства азотной кислоты);
(получение железа, доменный процесс);
(получение вольфрама);
(получение кремния).
Оксиды получают окислением кислородом простых и сложных веществ, (как неорганических, так и органических), а также термическим разложением гидроксидов (кислот, оснований, амфотерных гидроксидов), кислородсодержащих солей (табл. 1.2).
Таблица 1.2. Способы получения оксидов
| Способы получения оксидов | ||
|---|---|---|
| Взаимодействие простых и сложных веществ с кислородом | Разложение сложных веществ — оснований, солей, кислот | Другие способы |
Некоторые металлы (Мg, Zn), а также углерод образуют оксиды в реакциях с парами воды. Дополнительно отметим лабораторный способ получения оксида углерода(IV) реакцией обмена, в которой используют мрамор и соляную кислоту:
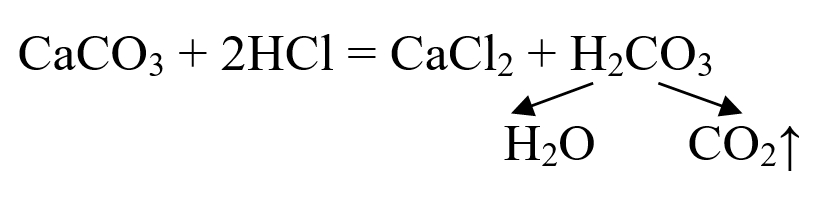
Получаемый оксид СО2 можно рассматривать как продукт разложения угольной кислоты.
Следует также помнить, что при окислении кислородом азотсодержащих веществ (аммиака NH3, аминов RNH2 и др.) азот выделяется в виде простого вещества N2, а оксид азота(II) образуется в присутствии катализатора.
Оксиды — сложные вещества, состоящие из двух элементов, одним из которых является кислород. Различают солеобразующие (основные, амфотерные, кислотные) и несолеобразующие оксиды.
Кислотные оксиды реагируют с водой, основными оксидами и щелочами, основные оксиды — с водой, кислотными оксидами и кислотами. Амфотерные оксиды вступают в реакции как с кислотами, так и со щелочами, а также с другими солеобразующими оксидами.
Распространённые способы получения оксидов — взаимодействие простых и сложных веществ с кислородом и термическое разложение оснований, кислородсодержащих солей или кислот.
Вопросы, задания, задачи
1. Назовите оксиды:
- а) элементов с постоянной валентностью — K2O, Al2O3, MgO;
- б) элементов с переменной валентностью — Ag2O, SO3, Mn2O7.
2. Составьте формулы оксидов:
- а) кальция, меди(II), меди(I), хрома(III), железа(III), азота(IV);
- б) соответствующих кислотам:
-
Кислота
Кислотный оксид
- в) соответствующих основаниям:
-
Основание
LiOH
NaOH
Ba(OH)2
Ca(OH)2
Fe(OH)2
Sr(OH)2
Основный оксид
3. Составьте уравнения реакций, характеризующих свойства оксидов:
- а) ВаО и FeO; б) SiO2 и SO2; в) MgO и ZnO. Укажите причины сходства и различия свойств оксидов в каждой паре.
4. Напишите уравнения реакций взаимодействия с кислородом следующих веществ: Сu, Al, ZnS, C2H2, С2Н5NH2, CH3OH.
5. Составьте уравнения реакций согласно схемам:
- а)
- б)
- в)
- г)
- д)
- е)
.
6. Дан перечень оксидов, формулы которых MgO, ZnO, NO, SiO2, SO3, P2O5, K2O. Какие из перечисленных оксидов будут реагировать с: а) гидроксидом натрия; б) серной кислотой? Составьте уравнения соответствующих реакций.
7. Рассчитайте объём (н. у.) сернистого газа, образующегося при обжиге пирита FeS2 массой 10 т, массовая доля примесей в котором составляет 6,25 %. Определите массу серной кислоты, которая могла быть получена при этом.
8. В столовой ложке помещается примерно 25 г уксуса. Определите объём углекислого газа, который выделится при взаимодействии данной порции уксуса с питьевой содой. Массовая доля уксусной кислоты в столовом уксусе составляет 9 %.
9. Молярная масса смеси оксидов углерода СO и СО2 равна 32 г/моль. Определите объёмную долю оксида углерода(II) в смеси.
10. Смесь оксидов магния и кальция массой 1,52 г растворили в азотной кислоте. При осторожном выпаривании и сушке получили смесь солей массой 4,76 г. Определите массы оксидов в исходной смеси.
Самоконтроль
1. Оксидами являются вещества, формулы которых:
- а) MgO;
- б) Н2О2;
- в) Fe2O3;
- г) OF2.
2. Только кислотные оксиды указаны в рядах:
- а) MgO, ZnO, NO;
- б) SiO2, SO3, P2O5;
- в) FeO, SiO2, SO2;
- г) N2O5, СO2, Mn2O7.
3. Правильными по отношению к оксиду бария являются утверждения:
- а) амфотерный;
- б) реагирует с водой;
- в) вступает в реакцию с кислотными оксидами;
- г) при повышенной температуре реагирует с оксидом алюминия.
4. Выберите схемы осуществимых реакций:
- а) СаО + HCl →;
- б) Al2O3 + Н2О →;
- в) ZnO + NaOH →;
- г) MgO + KOH →.
5. Количество серной кислоты, реагирующей с оксидом железа(II, III) массой 2,32 г, равно:
- а) 2 моль;
- б) 4 моль;
- в) 0,04 моль;
- г) 0,2 кмоль.