§ 4-1. Функцыі бялкоў
Бялкі выконваюць разнастайныя біялагічныя функцыі — структурную, транспартную, рэгулятарную і многія іншыя. Пры гэтым адной з самых важных функцый бялкоў у жывых арганізмах з’яўляецца каталітычная (ферментатыўная).
Ферменты. З курса хіміі вы ведаеце, што рэчывы, якія павышаюць хуткасць хімічных рэакцый, называюцца каталізатарамі. Ферменты *(энзімы)* — гэта бялкі, якія выконваюць функцыі біялагічных каталізатараў, г. зн. паскараюць працяканне хімічных рэакцый у жывых арганізмах. Без іх удзелу біяхімічныя працэсы адбываліся б занадта павольна ці не адбываліся б наогул. Ферменты ажыццяўляюць расшчапленне і сінтэз розных злучэнняў, забяспечваючы абмен рэчываў. Практычна ўсе працэсы жыццядзейнасці абумоўлены ферментатыўнымі рэакцыямі.
*Ферменты ўяўляюць сабой глабулярныя бялкі трацічнай ці чацвярцічнай структуры. У састаў малекул многіх ферментаў акрамя поліпептыднага кампанента (апаферменту) уваходзяць таксама рэчывы небялковай прыроды — кафактары. У ролі кафактараў могуць выступаць неарганічныя іоны (Mg2+, Fe2+, Zn2+ і інш.) ці каферменты — нізкамалекульныя арганічныя злучэнні. Часцей за ўсё каферментамі з'яўляюцца вітаміны і іх вытворныя.*
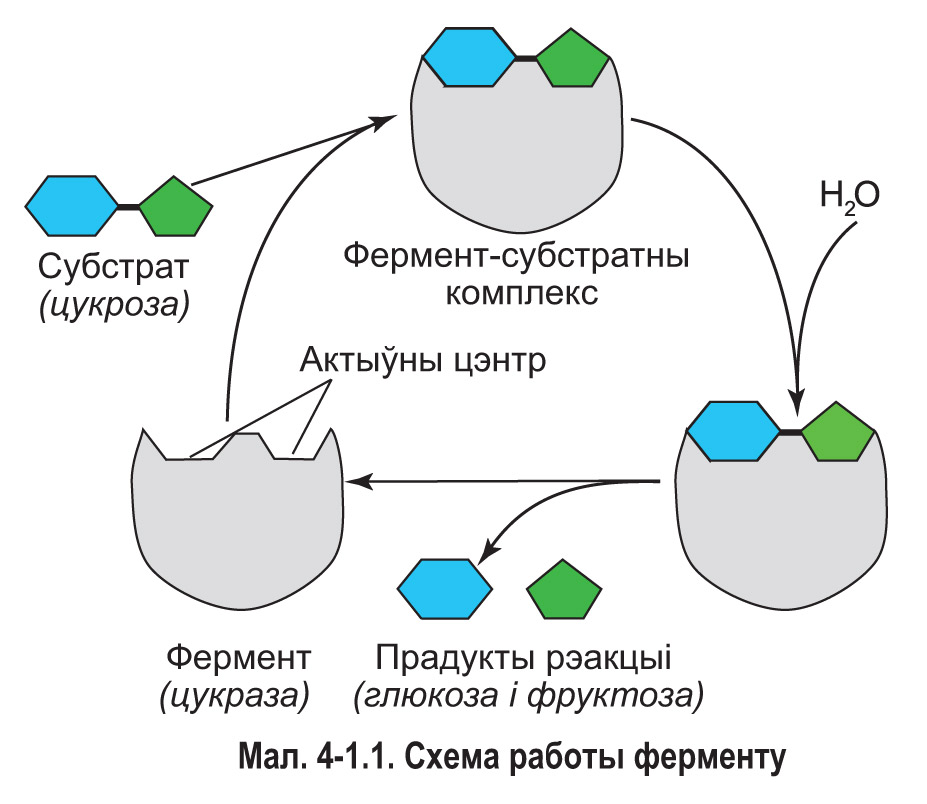
Ферменты паскараюць хімічныя рэакцыі за кошт цеснага ўзаемадзеяння з малекуламі субстратаў — зыходных рэчываў, якія рэагуюць. З субстратам (ці субстратамі) узаемадзейнічае не ўся малекула ферменту, а толькі невялікі яе ўчастак — актыўны цэнтр. Часцей за ўсё ён утвораны некалькімі амінакіслотнымі астаткамі. Актыўны цэнтр кожнага ферменту мае асаблівую форму і хімічную будову, таму з ім могуць звязвацца толькі пэўныя субстраты (мал. 4-1.1).
Далучэнне субстрату выклікае невялікія змяненні канфігурацыі актыўнага цэнтра — такія, каб максімальна адпавядаць субстрату. Функцыянальна актыўныя групы ферменту, за кошт якіх будзе працякаць рэакцыя, найбольш спрыяльным чынам размяшчаюцца ў прасторы. Вобразна кажучы, актыўны цэнтр падладжваецца пад субстрат як пальчатка, якую надзяваюць на руку.
У выніку далучэння да актыўнага цэнтра малекула субстрату асаблівым чынам размяшчаецца ў прасторы, і ў яе структуры аслабляюцца пэўныя хімічныя сувязі. Рэакцыйная здольнасць субстрату ўзрастае. Таму, у параўнанні з некаталізаванай рэакцыяй, ферментатыўнае ператварэнне субстрату ў прадукт (ці прадукты) адбываецца з меншымі затратамі энергіі і значна большай хуткасцю. Утвораныя прадукты аддзяляюцца ад актыўнага цэнтра. Пасля гэтага ён можа прымаць новыя малекулы субстрату.
Падабенства ферментаў да звычайных хімічных каталізатараў праяўляецца ў тым, што і тыя і другія павялічваюць хуткасць рэакцыі, але пры гэтым не расходуюцца і могуць выкарыстоўвацца шматразова.
У адрозненне ад звычайных хімічных каталізатараў ферменты валодаюць спецыфічнасцю, г. зн. кожны фермент паскарае толькі адну пэўную рэакцыю ці дзейнічае толькі на адзін тып сувязі. Гэта асаблівасць тлумачыцца адпаведнасцю актыўнага цэнтра ферменту пэўным субстратам. Ферменты працуюць значна хутчэй (яны паскараюць рэакцыі ў мільёны і мільярды разоў, а неарганічныя каталізатары — у сотні і тысячы разоў), таму нават у вельмі малых канцэнтрацыях ферменты забяспечваюць інтэнсіўнае працяканне каталізаваных рэакцый.
У ходзе некаторых акісляльна-аднаўленчых працэсаў, якія праходзяць у жывых арганізмах, утвараецца таксічнае для клетак злучэнне — пераксід вадароду (Н2О2). Без удзелу каталізатараў яго расшчапленне ідзе вельмі павольна: 2H2O2 → 2H2O + O2. Вы ведаеце, што ў лабараторыі пры правядзенні гэтай рэакцыі звычайна выкарыстоўваюць неарганічны каталізатар, напрыклад аксід марганцу (MnO2). У яго прысутнасці раскладанне Н2О2 адбываецца значна хутчэй. У жывых арганізмах пад дзеяннем ферменту каталазы гэты працэс працякае з дзіўна высокай хуткасцю: адна малекула каталазы расшчапляе за 1 с каля 200 000 малекул H2O2!
Ферменты з’яўляюцца бялкамі, таму актыўна працуюць толькі ў пэўным дыяпазоне рН, тэмпературы і іншых фактараў. Напрыклад, фермент страўнікавага соку пепсін актыўны толькі ў кіслым асяроддзі, а ферменты сліны амілаза і мальтаза — у слабашчолачным. У дыяпазоне 0—40 °С павышэнне тэмпературы прыводзіць да паскарэння ферментатыўных рэакцый. Але пры далейшым павелічэнні тэмпературы рэакцыі, якія каталізуюцца большасцю ферментаў, запавольваюцца, а затым і зусім спыняюцца. Значнае павышэнне тэмпературы, змяненне кіслотнасці асяроддзя і іншых фактараў прыводзіць да дэнатурацыі ферментаў, у выніку чаго яны губляюць здольнасць звязвацца са сваімі субстратамі.
*Існуюць ферменты, якія, акрамя актыўнага цэнтра, маюць адзін ці некалькі рэгулятарных (аластэрычных) цэнтраў. З актыўным ці рэгулятарным цэнтрам або з іншымі ўчасткамі малекулы ферменту могуць звязвацца пэўныя рэчывы, якія ўплываюць на яго актыўнасць. Рэчывы, што павышаюць хуткасць ферментатыўнай рэакцыі, называюцца актыватарамі, а тыя, што зніжаюць ці блакіруюць актыўнасць ферменту — інгібітарамі.
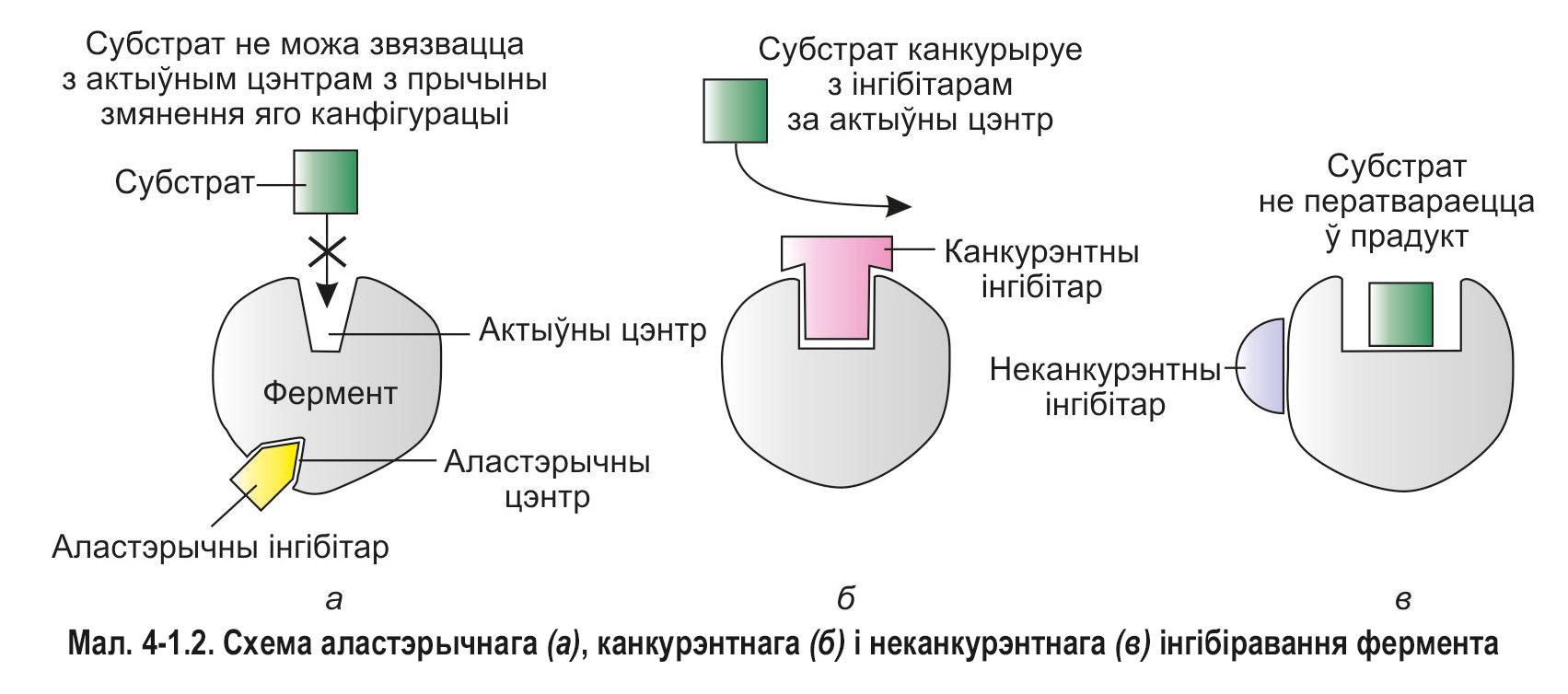
Інгібітары, якія звязваюцца з рэгулятарным (аластэрычным) цэнтрам, выклікаюць змяненні прасторавай канфігурацыі (канфармацыі) ферменту, прыводзяць да змяншэння яго актыўнасці. Такі тып інгібіравання называецца аластэрычным (мал. 4-1.2, а).
Некаторыя злучэнні, па структуры падобныя да субстрату, могуць звязвацца з актыўным цэнтрам ферменту, але не здольныя праходзіць ферментатыўнае ператварэнне. Такія рэчывы перашкаджаюць доступу субстрату ў актыўны цэнтр, тым самым зніжаючы хуткасць ферментатыўнай рэакцыі. Паколькі малекулы субстрату і інгібітару канкурыруюць за актыўны цэнтр, дадзены тып інгібіравання названы канкурэнтным (мал. 4-1.2, б). Канкурэнтныя інгібітары нярэдка выкарыстоўваюцца ў якасці лекавых сродкаў.
Вядома таксама неканкурэнтнае інгібіраванне, пры якім інгібітары далучаюцца да малекулы ферменту па-за актыўным і рэгулятарным цэнтрамі. Неканкурэнтныя інгібітары не перашкаджаюць злучэнню ферментаў з субстратамі, але выклікаюць такія змяненні структуры, якія не дазваляюць ферменту ператвараць субстрат у прадукт (мал. 4-1.2, в). Прыкладам могуць служыць цыянід-іоны (CN–). Яны прыгнятаюць актыўнасць шэрага ферментаў за кошт злучэння з іонамі металаў, што выконваюць ролю кафактараў.*
*Ферменты шырока выкарыстоўваюцца ў харчовай прамысловасці (пры вытворчасці сыроў і іншых кісламалочных прадуктаў, сокаў, чаю, пюрэ з садавіны і агародніны, у хлебапячэнні, піваварстве, вінаробстве, для апрацоўкі мяса і г. д.). Іх таксама ўжываюць у сельскай гаспадарцы для атрымання кармоў, у медыцыне для дыягностыкі і лячэння захворванняў, у тэкстыльнай і гарбарнай прамысловасці для апрацоўкі тканін, скуры і футра, у вытворчасці сінтэтычных мыйных сродкаў і інш.*
Акрамя каталітычнай, бялкі выконваюць і іншыя важныя функцыі (табліца 4-1.1).
Табліца 4-1.1. Асноўныя функцыі бялкоў у жывых арганізмах
|
Функцыя |
Тлумачэнне і прыклады |
|
Каталітычная (ферментатыўная) |
З’яўляюцца біялагічнымі каталізатарамі — павялічваюць хуткасць праходжання біяхімічных рэакцый, чым забяспечваюць расшчапленне і сінтэз розных злучэнняў. Напрыклад, стрававальныя ферменты ліпазы паскараюць расшчапленне ліпідаў, амілаза і мальтаза — вугляводаў, пепсін і трыпсін — бялкоў. *Рыбулозадыфасфат-карбаксілаза забяспечвае звязванне вуглякіслага газу ў працэсе фотасінтэзу. Падваенне малекул ДНК адбываецца пад дзеяннем ферменту ДНК-палімеразы, утварэнне РНК — пад дзеяннем РНК-палімеразы* |
|
Структурная |
Уваходзяць у састаў усіх кампанентаў клетак і розных пазаклетачных структур. Напрыклад, керацін — асноўны кампанент валасоў, пазногцяў, кіпцюроў, капытоў, рагоў, пёраў. Эласцін уваходзіць у састаў сценак артэрый, звязак і інш., калаген — у састаў скуры, сухажылляў, касцявой, храстковай і іншых тканак. *Склерацін з’яўляецца кампанентам вонкавага шкілета насякомых і павукападобных. Фібраін складае аснову коканаў насякомых* |
|
Транспартная |
Пераносяць розныя рэчывы ад адных клетак і тканак да другіх, забяспечваюць іх паступленне ў клеткі, вывядзенне з клетак, а таксама працэсы ўнутрыклетачнага транспарту. Напрыклад, дыхальны пігмент гемаглабін пераносіць кісларод і вуглякіслы газ у крыві пазваночных жывёл, а ў многіх малюскаў і ў шэрагу членістаногіх гэту функцыю выконвае гемацыянін. Глабуліны плазмы крыві транспартуюць гармоны і іоны металаў (напрыклад, трансферын — іоны жалеза, цэрулаплазмін — іоны медзі), альбуміны пераносяць вышэйшыя карбонавыя кіслоты і некаторыя іншыя рэчывы* |
|
Скарачальная |
Прымаюць удзел ва ўсіх відах руху, да якіх здольныя клеткі і арганізмы. Напрыклад, бялкі акцін і міязін забяспечваюць скарачальнасць гладкай і папярочнапаласатай мышачных тканак. *У аснове руху жгуцікаў і раснічак эўкарыятычных клетак ляжыць слізганне адна адносна адной мікратрубачак, што ўваходзяць у іх састаў. Яно забяспечваецца ўзаемадзеяннем бялкоў тубуліну і дынеіну* |
|
Рэгулятарная |
Рэгулююць працяканне розных фізіялагічных працэсаў. Напрыклад, гармоны інсулін і глюкагон рэгулююць узровень глюкозы ў крыві. Працэсы росту і фізічнага развіцця чалавека працякаюць пад кантролем гармону самататрапіну. *Іншыя тропныя гармоны, якія сакрэтуюць пярэдняя і сярэдняя долі гіпофіза, таксама ўяўляюць сабой поліпептыды. Напрыклад, тырэятрапін, што стымулюе дзейнасць шчытападобнай залозы, ганадатрапіны, што рэгулююць работу палавых залоз, пралакцін, што кантралюе развіццё і функцыянаванне малочных залоз і г. д. Гармон шчытападобнай залозы кальцытанін і паратгармон, які выпрацоўваецца парашчытападобнымі залозамі, рэгулююць утрыманне іонаў Са2+ у арганізме* |
|
Сігнальная |
Некаторыя мембранныя бялкі ў адказ на дзеянне пэўных хімічных рэчываў ці раздражняльнікаў іншай прыроды змяняюць сваю канфігурацыю. Гэта прыводзіць да змянення працякання тых ці іншых унутрыклетачных працэсаў. Такім чынам, рэцэптарныя бялкі забяспечваюць прыём знешніх сігналаў і рэакцыі клетак у адказ на гэтыя сігналы. Напрыклад, зрокавыя пігменты вока — радапсін (змяшчаецца ў палачках) і ёдапсіны (у колбачках) — забяспечваюць успрыманне святла фотарэцэптарнымі клеткамі, іх узбуджэнне і запуск нервовага імпульсу. *Іншымі прыкладамі могуць служыць мембранныя рэцэптары, якія злучаюць малекулы гармонаў, нейрамедыятараў і інш. Святлоадчувальны бялок фітахром забяспечвае рэакцыю раслін на змяненне даўжыні светлавога дня (фотаперыядызм). Ён адыгрывае важную ролю ў рэгуляцыі цвіцення, прарастання насення, фарміравання лістоў і г. д.* |
|
Ахоўная |
Тромбапластын, трамбін і фібрынаген забяспечваюць згусанне крыві, ахоўваючы арганізм ад страты крыві. Імунаглабуліны (антыцелы) удзельнічаюць у імунным адказе арганізма на чужародныя аб’екты — антыгены. Лізацым, які змяшчаецца ў сліне, слёзнай вадкасці і інш., валодае антыбактэрыяльнымі ўласцівасцямі. *Ад бактэрыяльных і іншых чужародных клетак арганізм ахоўваюць таксама бялкі сістэмы камплементу, якія ўвесь час прысутнічаюць у крыві. Інтэрфероны валодаюць супрацьвірусным дзеяннем* |
|
Таксічная |
Таксіны, што вылучаюць многія бактэрыі (дыфтэрыйны, батулінавы, слупняковы, халерны і інш.), па хімічнай прыродзе з’яўляюцца бялкамі. Дзеючыя рэчывы ў саставе ядаў змей, некаторых павукоў, скарпіёнаў і насякомых таксама ўяўляюць сабой бялкі |
|
Запасальная |
Назапашваюцца ў якасці крыніцы амінакіслот (напрыклад, рэзервовыя бялкі, якія адкладаюцца ў насенні раслін) (*легумін, які назапашваецца ў насенні бабовых і інш.)*. *Ферыцін выконвае ролю асноўнага ўнутрыклетачнага дэпо жалеза ў чалавека і жывёл* |
|
Энергетычная |
Пасля гідролізу да амінакіслот могуць далей расшчапляцца і акісляцца з вызваленнем энергіі. Пры поўным акісленні 1 г бялку вылучаецца 17,6 кдж энергіі. Аднак бялкі выкарыстоўваюцца ў якасці крыніцы энергіі толькі ў крайніх выпадках, калі заканчваюцца запасы вугляводаў і тлушчаў |
* Натуральны шоўк, які атрымліваюць з коканаў шаўкапрада, на 75 % складаецца з фібраіну і на 25 % з серыцыну. Фібраін — нерастваральны бялок, другасная структура якога (β-складкаваты слой) абумоўлівае трываласць шоўку. Валокны шоўку ўтвораны фібраінавымі ніткамі. Звонку яны пакрыты клейкім водарастваральным серыцынам, які пры вытворчасці тканін выдаляецца. Шаўковая нітка мае трохвугольнае сячэнне і, як прызма, праламляе святло, што выклікае прыгожае пераліванне і бляск. Шоўк выкарыстоўваўся для вырабу тканін яшчэ ў IV ст. да н. э. Шаўковае валакно ўжываюць у якасці шыўнага матэрыялу ў хірургіі.
У павукоў аснову павуціны складае бялок спідраін. Сакрэт павуцінных залоз выводзіцца вонкі ў вадкім выглядзе. Пасля гэтага структура спідраіну змяняецца, і ён цвярдзее ў выглядзе тонкіх нітак. У іх складзе ўчасткі β-складкаватага слоя чаргуюцца з эластычнымі поліпептыднымі звязкамі. Дзякуючы гэтаму павуціна валодае адначасова высокай трываласцю і эластычнасцю. Яна раздзіраецца толькі пры расцягванні ў 5 разоў. Па трываласці павуціна супастаўляецца са сталлю, але пры гэтым яе шчыльнасць у 6 разоў меншая, чым у сталі. Калі б павук стварыў нітку даўжынёй з зямны экватар, яна мела б масу менш за 500 г.