§ 3. Органические вещества. Аминокислоты. Олигопептиды
| Сайт: | Профильное обучение |
| Курс: | Биология. 11 класс |
| Книга: | § 3. Органические вещества. Аминокислоты. Олигопептиды |
| Напечатано:: | Гость |
| Дата: | Sunday, 31 August 2025, 22:16 |
Низкомолекулярные и высокомолекулярные органические вещества. Неотъемлемой составляющей всего живого являются органические вещества, название которых происходит от слова «организм». Эти соединения обеспечивают протекание важнейших процессов жизнедеятельности, и жизнь на Земле без их участия невозможна. Органические вещества составляют в среднем 20—30 % массы живых организмов. Их молекулы состоят, главным образом, из атомов углерода, водорода и кислорода. В состав многих биологически важных органических соединений входят и другие элементы. Например, молекулы белков также содержат азот и серу, нуклеиновые кислоты — азот и фосфор.
Низкомолекулярные органические вещества характеризуются сравнительно небольшой молекулярной массой и относительно простым строением. Это аминокислоты, моносахариды, нуклеотиды, карбоновые кислоты, спирты и т. п. Сложные по структуре соединения, молекулярная масса которых составляет от нескольких тысяч до миллионов, называют высокомолекулярными. К ним относятся белки, полисахариды и нуклеиновые кислоты. Молекулы этих веществ состоят из множества повторяющихся звеньев — мономеров, которые могут быть одинаковыми или различаться по составу. Из курса химии вы знаете, что такие соединения называются полимерами. Мономерами белков являются аминокислоты, мономерами полисахаридов — моносахариды, молекулы нуклеиновых кислот построены из нуклеотидов (рис. 3.1).
Белки, полисахариды и нуклеиновые кислоты содержатся в клетках всех живых организмов и выполняют исключительно важные биологические функции, поэтому их называют биологическими полимерами (биополимерами).
*Полимеры, в состав которых входят одинаковые либо разные мономерные звенья, но при этом в их чередовании наблюдается определенная закономерность, называются регулярными. В структуре нерегулярных полимеров подобная закономерность отсутствует. Например, если мы обозначим два типа мономеров буквами А и Б, то полимеры, имеющие структуру ...А—А—А—А—А—А... или ...А—Б—А—Б—А—Б..., будут являться регулярными. Среди биополимеров встречаются как регулярные — полисахариды, так и нерегулярные — белки и нуклеиновые кислоты.
Кроме полимеров существуют также олигомеры. Их молекулы образованы сравнительно небольшим числом мономеров — как правило, до 10. К этой группе относятся олигопептиды, олигосахариды и олигонуклеотиды (см. рис. 3.1).*
Из всех групп органических веществ в клетках растений преобладают полисахариды, а в клетках животных — белки. Но несмотря на некоторые различия в количественном соотношении тех или иных органических соединений, вещества, принадлежащие к определенной группе, у всех живых организмов выполняют сходные функции. При этом наибольшее разнообразие биологических функций характерно для белков.
Аминокислоты — мономеры белковых молекул. Аминокислоты — органические соединения, содержащие одновременно аминогруппу (—NН2), обладающую оснóвными свойствами, и карбоксильную группу (—СООН), проявляющую кислотные свойства. В составе живых организмов обнаружены сотни аминокислот, но в образовании белков участвует лишь 20 из них. Такие аминокислоты называют белокобразующими, их полные и сокращенные названия представлены в таблице 3.1 (не для запоминания).
Таблица 3.1. Белокобразующие аминокислоты
|
Аминокислота |
Сокращенное название |
Аминокислота |
Сокращенное название |
|
Аланин |
Ала |
Лейцин |
Лей |
|
Аргинин |
Арг |
Лизин |
Лиз |
|
Аспарагин |
Асн |
Метионин |
Мет |
|
Аспарагиновая кислота |
Асп |
Пролин |
Про |
|
Валин |
Вал |
Серин |
Сер |
|
Гистидин |
Гис |
Тирозин |
Тир |
|
Глицин |
Гли |
Треонин |
Тре |
|
Глутамин |
Глн |
Триптофан |
Трп |
|
Глутаминовая кислота |
Глу |
Фенилаланин |
Фен |
|
Изолейцин |
Иле |
Цистеин |
Цис |
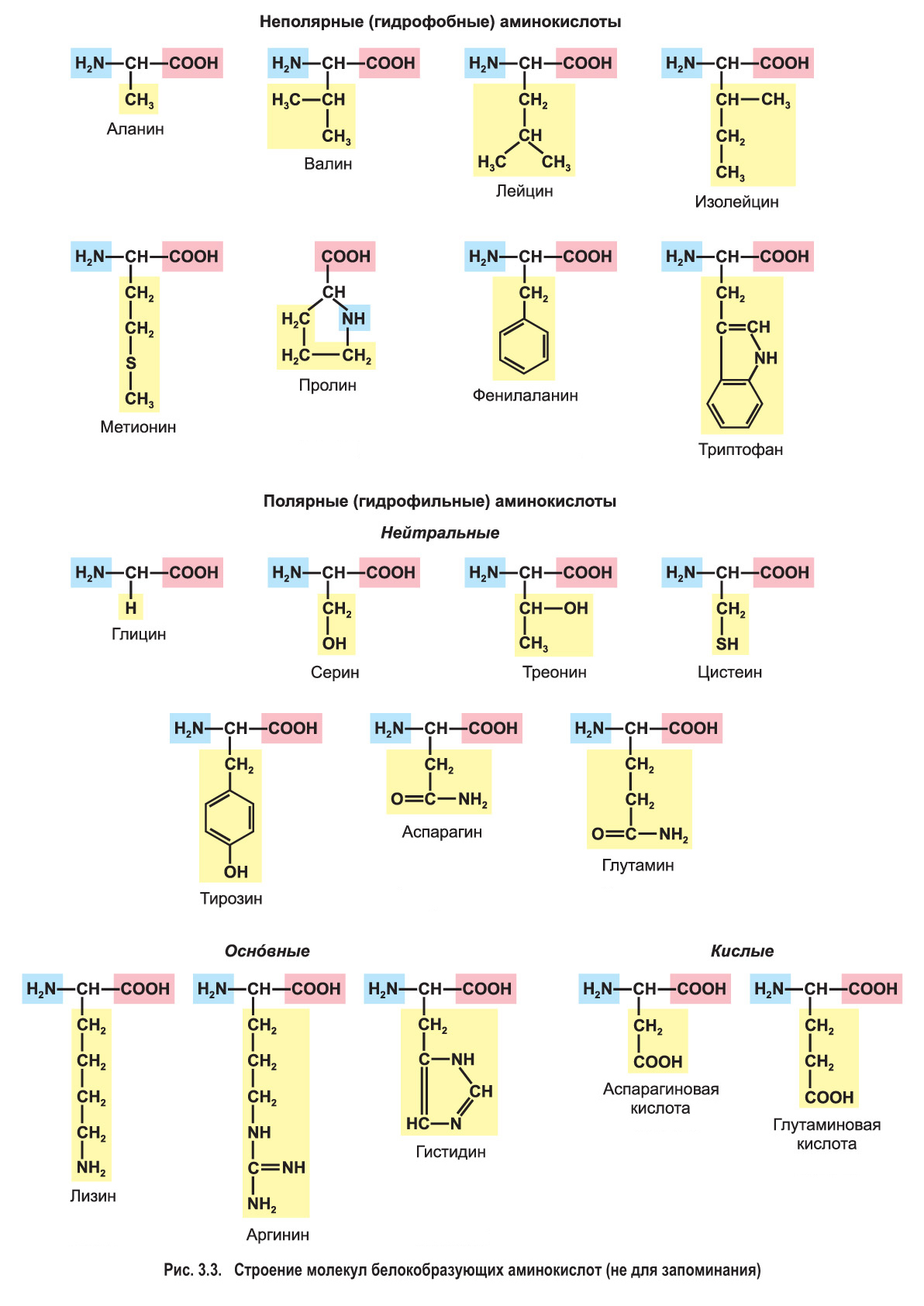
В молекулах белокобразующих аминокислот аминогруппа и карбоксильная группа присоединены к одному и тому же атому углерода (т. е. все они являются α-аминокислотами). С этим же атомом углерода связан радикал (R), который у каждой аминокислоты имеет особое строение и определяет ее специфические свойства (рис. 3.2).
Радикалы аминокислот могут быть неполярными (гидрофобными) или полярными (гидрофильными), содержать различные функциональные группы. Например, радикал серина содержит гидроксильную группу (—ОН), радикал цистеина — серосодержащую группу (—SH). Некоторые аминокислоты имеют циклические радикалы (рис. 3.3). Все это играет важную роль в формировании пространственной структуры белков.
Молекулы большинства белокобразующих аминокислот содержат одну аминогруппу и одну карбоксильную группу — это нейтральные аминокислоты. Некоторые аминокислоты имеют дополнительные амино- или карбоксильные группы в составе радикала. Такие аминокислоты соответственно называются оснóвными или кислыми (см. рис. 3.3).
Автотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофных организмов источником аминокислот является пища. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми. Другие же, так называемые незаменимые аминокислоты, не могут быть синтезированы в организме и поэтому должны постоянно поступать в него в составе белков пищи.
*Полноценные пищевые белки содержат остатки всех незаменимых аминокислот. Белки пищи, в составе которых отсутствуют остатки каких-либо незаменимых аминокислот, называют неполноценными.*
Для человека незаменимыми аминокислотами являются: триптофан, валин, лизин, изолейцин, треонин, фенилаланин, метионин и лейцин. Запоминать их перечень необязательно, но при желании можете воспользоваться мнемоническими правилами. Например: «ТРи Подруги — ВАЛя, ЛИЗа И ЛЕнка ТРЕбовали ФЕН и МЕТаллическую ЛЕЙку».
*Частично заменимые аминокислоты — аргинин и гистидин — синтезируются у человека в небольшом количестве, недостаточном для нормального функционирования организма, особенно в детском возрасте. Поэтому они должны дополнительно поступать в составе пищевых белков.*
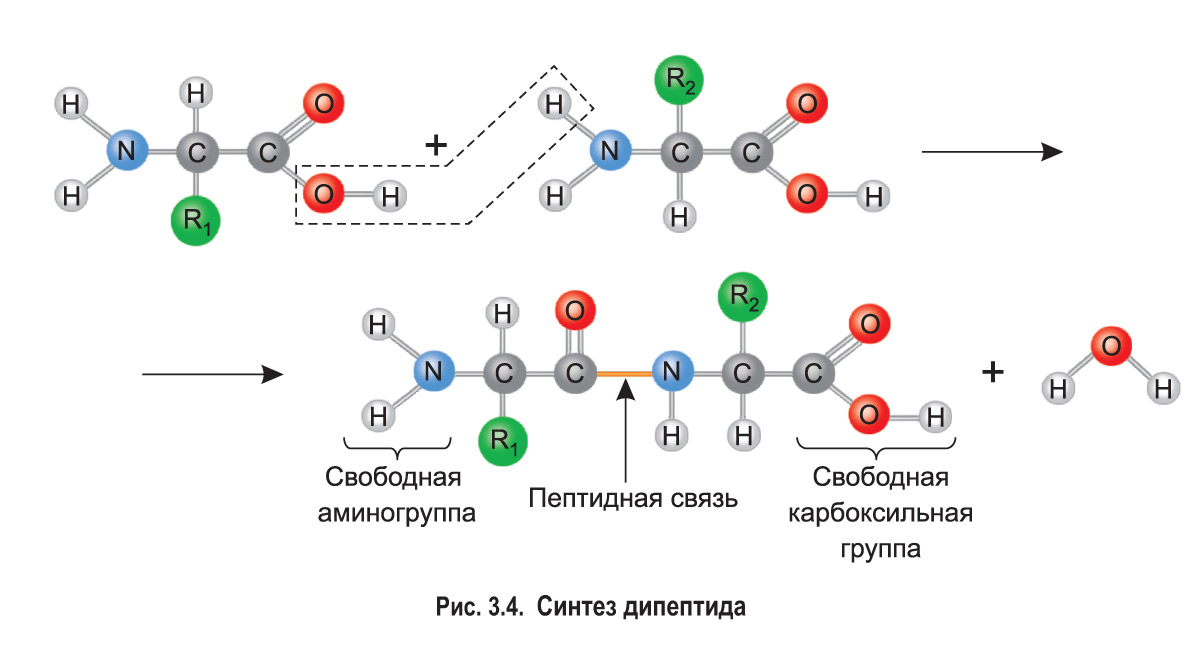
Наличие одновременно аминогруппы и карбоксильной группы обусловливает амфотерность аминокислот и их высокую реакционную способность. Как вы помните из курса химии, карбоксильная группа (—СООН) одной аминокислоты может взаимодействовать с аминогруппой (—NH2) другой аминокислоты. При этом от карбоксильной группы отщепляется группа —ОН, а от аминогруппы — атом водорода. В результате выделяется молекула воды, а между атомом углерода карбоксильной группы и атомом азота аминогруппы возникает ковалентная связь, которая называется пептидной связью (рис. 3.4).
Так образуется дипептид, который имеет на одном конце свободную аминогруппу, а на другом — свободную карбоксильную группу. Поэтому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды и далее полипептиды.
*Структуру олиго- и полипептидов принято записывать слева направо в направлении от конца, содержащего свободную аминогруппу (так называемый N-конец), к концу, имеющему свободную карбоксильную группу (С-конец). Например, дипептиды Глу—Ала и Ала—Глу имеют различную структуру: у первого остаток глутаминовой кислоты имеет свободную группу —NH2, а остаток аланина — группу —СООН, а у второго — наоборот.*
*Олигопептиды образованы сравнительно небольшим количеством аминокислотных остатков — до 10. Некоторые природные олигопептиды содержат остатки необычных аминокислот, редко встречающихся в живой природе и не входящих в состав белков. Биологические функции олигопептидов разнообразны.
Так, олигопептидами являются известные вам гормоны окситоцин и вазопрессин (вспомните их роль в организме человека). Гормон ангиотензин II также представляет собой олигопептид. Он обладает сосудосуживающим действием, а также стимулирует секрецию других гормонов, например альдостерона, некоторых гормонов передней доли гипофиза.*
*Противоположное действие на тонус кровеносных сосудов оказывают олигопептиды брадикинин и каллидин — они способствуют расширению сосудов, снижая тем самым кровяное давление. Некоторые олигопептиды являются иммунорегуляторами. Например, тафтсин усиливает фагоцитоз, обладает бактерицидным и противоопухолевым действием.*
*На сегодняшний день известно достаточно много пептидов, оказывающих воздействие на нервную систему и поведение животных и человека. Они играют важную роль в формировании эмоций, мотиваций, привязанности, пищевого поведения, регулируют сон и бодрствование, реакции организма на стресс и боль, участвуют в формировании памяти и т. д.*
*Например, эндорфины и энкефалины, многие из которых имеют олигопептидную природу, обладают мощным обезболивающим действием, улучшают самочувствие и настроение человека. Известно, что повышению уровня этих нейропептидов способствуют новые позитивные впечатления, занятия спортом, прослушивание приятной музыки и т. п. Выработка эндорфинов и энкефалинов резко увеличивается в ответ на стресс и боль как защитная реакция (например, во время тяжелого физического труда, спортивных соревнований, боевых действий и др.). Их действие способствует мобилизации ресурсов организма, его адаптации к различным нагрузкам и выходу из состояния стресса. Подобным действием обладает и так называемый пептид δ-сна, который также участвует в регуляции суточных ритмов. Пептид эндозепин-6, наоборот, вызывает чувство беспокойства, стимулирует агрессивное поведение человека и животных. Олигопептид холецистокинин, способствуя выведению желчи и сока поджелудочной железы в двенадцатиперстную кишку, принимает участие в регуляции пищеварения. Кроме того, он влияет на пищевое поведение человека, вызывая чувство сытости и снижая аппетит.*
*Олигопептидами по химической природе являются и некоторые антибиотики (грамицидин и др.). Также среди олигопептидов известны вещества, обладающие высокой токсичностью для человека и животных. Это, например, аманитины и фаллоидин, содержащиеся в бледной поганке и некоторых других грибах. Эти токсины представляют большую угрозу для здоровья и жизни, вызывая гибель клеток печени, почек и других органов.*

Органические вещества живых организмов представлены как низкомолекулярными соединениями, так и высокомолекулярными — биополимерами. В состав молекул биополимеров входит множество структурных звеньев — мономеров. Существуют также олигомеры, молекулы которых образованы сравнительно небольшим числом мономерных звеньев.
Аминокислоты относятся к низкомолекулярным веществам. Соединяясь пептидными связями, они образуют олиго- и полипептиды. Олигопептиды выполняют различные биологические функции.
 |
1. Какие из представленных веществ являются биологическими полимерами? Какие вещества являются мономерами для построения молекул биополимеров? 2. Какие функциональные группы характерны для всех аминокислот? Какими свойствами обладают эти группы? 3. Сколько аминокислот участвует в образовании природных белков? Назовите общие черты строения этих аминокислот. Чем они различаются? 4. Как происходит соединение аминокислот в полипептидную цепь? 5. Что представляют собой олигопептиды? Какие биологические функции они выполняют? 6*. Трипептид глутатион, обладающий антиоксидантными свойствами, имеет структуру: Глу—Цис—Гли. Он необычен тем, что в образовании пептидной связи между остатками глутаминовой кислоты и цистеина участвует не α-карбоксильная, а γ-карбоксильная группа глутаминовой кислоты, входящая в состав радикала. Запишите структурную формулу глутатиона, рассчитайте его молекулярную массу. Для выполнения задания используйте структурные формулы аминокислот, показанные на рисунке 3.3. |

Биуретовая реакция — качественная реакция на пептидные связи
Задание рекомендуется выполнять в школе.
С помощью биуретовой реакции определим, в каких пищевых продуктах содержатся белки.
Для проведения реакции понадобятся раствор какой-либо щелочи (например, NaOH) и раствор медного купороса — сульфата меди (II). Вместо чистой щелочи можно использовать средство для удаления жировых загрязнений или прочистки канализационных труб (щелочи — основной компонент таких средств, но предварительно прочитайте состав) либо кальцинированную соду. Вместо медного купороса можно использовать бордосскую смесь. Это распространенное средство защиты растений от болезней, в упаковке содержатся два пакета: с медным купоросом и гашеной известью — Са(OH)2. На основе бордосской смеси можно получить оба раствора для проведения биуретовой реакции.
- Приготовьте небольшое количество растворов щелочи и медного купороса. Будьте осторожны при работе с реактивами, соблюдайте правила техники безопасности!
- Подготовьте образцы пищевых продуктов — раствор яичного белка или желатина, молоко, кефир, мясной или рыбный бульон (желательно процеженный), отвар каких-либо овощей или грибов, светлый сок (березовый, яблочный, лимонный), минеральную воду и т. п.
- К небольшому количеству исследуемого продукта добавьте немного раствора щелочи, а затем 1—2 мл раствора медного купороса. Если в испытуемом продукте есть белок, окраска раствора станет фиолетовой.
● Вспомните, какие пищевые продукты являются основными источниками белков для человека.
● В каких исследованных вами продуктах были обнаружены белки?