§ 32. Излучение и поглощение света атомом. Спектры испускания и поглощения
|
Модель атома Бора позволяет описать процессы излучения и поглощения света атомом. Как это происходит? Как фотон «появляется на свет»? Что меняется в атоме после поглощения фотона? |
Вследствие того что энергия атома квантована, она характеризуется определенным набором энергетических уровней En. Испускание излучения происходит при самопроизвольном переходе атома с высших энергетических уровней Ek на один из низших энергетических уровней En (Ek > En) Атом излучает фотон (квант электромагнитной энергии) с энергией .
Частота излучения при этом:
| (1) |
Подчеркнем, что наряду с прямым переходом атом может переходить из возбужденного состояния в основное поэтапно, через промежуточные состояния. При этом излучаются соответствующие промежуточным переходам кванты света. Набор таких частот образует линейчатый спектр излучения атома.
Поглощение света — процесс, обратный испусканию. Атом, поглощая фотон hνkn = En - Ek переходит из низшего k состояния в более высокое n (Ek < En) состояние. Частота поглощенного фотона:
| (2) |
Подобные переходы дают линейчатый спектр поглощения атома.
Подчеркнем, что частоты переходов с испусканием и поглощением, происходящие между одними и теми же энергетическими уровнями, совпадают.
Таким образом, спектры атомов позволяют определять изменения энергии атома при испускании или поглощении ими излучения.
Спектры, полученные от самосветящихся тел, называются спектрами испускания. Они бывают трех типов: линейчатые, полосатые и сплошные.
Линейчатые спектры имеют все вещества в газообразном атомарном состоянии. Обычно (например, при нормальных условиях) атомы газа находятся в основном состоянии и не излучают света. Если такой газ нагревается, некоторые атомы переходят на более высокие энергетические уровни. Именно эти атомы при переходе в более низкие энергетические состояния и испускают фотоны. В результате атомарные спектры состоят из отдельных узких линий различного цвета, разделенных темными промежутками (рис. 199).
Изучение линейчатых спектров показало, что каждый химический элемент обладает своим строго индивидуальным спектром. Такие спектры отличаются друг от друга цветом отдельных светящихся линий, их положением и числом.
Полосатые спектры имеют газы, состоящие из молекул. Для объяснения молекулярных спектров необходимо принимать во внимание большую сложность структуры молекул. В молекулах, кроме движения электронов, происходят колебательное движение ядер около положения равновесия и вращательное движение молекулы как целого. Согласно квантовой механике энергия всех видов движения может принимать только определенные дискретные значения (квантуется). Полная энергия молекулы определяется тремя видами ее внутренних движений. Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии: электронные, колебательные и вращательные. При соединении атомов в молекулы каждый атомный уровень превращается в ряд близких уровней, соответствующих колебательным и вращательным движениям. Так как расстояние между этими уровнями очень мало, особенно в случае вращательных уровней (характерное расстояние между уровнями составляет эВ), то в результате переходов между этими уровнями возникает множество очень близких спектральных линий.
В таких спектрах в отличие от атомных спектров совокупность тесно расположенных спектральных линий образуют полосы, разделенные темными промежутками (рис. 200). Спектры молекул можно использовать для идентификации молекул и их структуры.
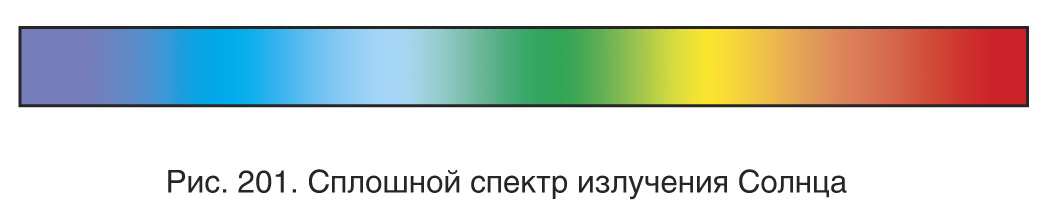
Непрерывные (сплошные) спектры имеют нагретые тела, находящиеся в твердом и жидком состоянии, а также газы при высоком давлении и плазма. Вследствие интенсивного взаимодействия между молекулами индивидуальные черты, присущие отдельным частицам, в таких спектрах неразличимы. В них представлены все длины волн, нет темных промежутков и на экране видна сплошная разноцветная полоса (рис. 201).
Прозрачные вещества поглощают часть падающего на них излучения, и в спектре, полученном после прохождения белого света через такие вещества, появляются темные линии, или полосы поглощения. Такой спектр называется спектром поглощения (рис. 202).
 |
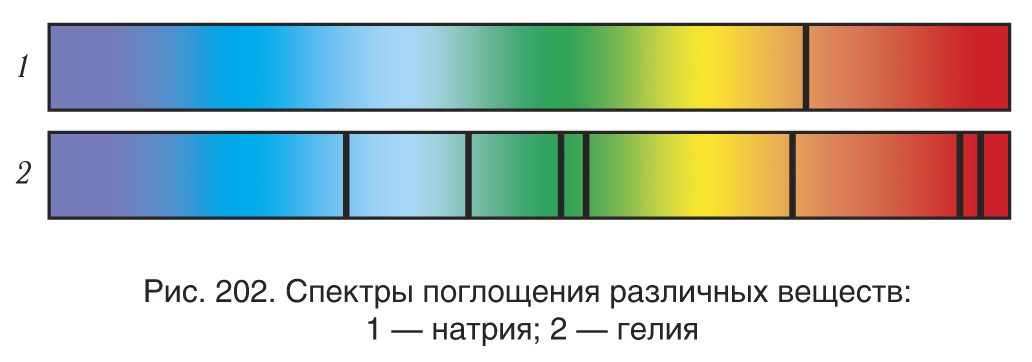 |
Так, вещество в газообразном состоянии поглощает наиболее сильно свет тех длин волн, которые оно испускает в нагретом состоянии.
Это означает, что темные линии в спектре поглощения будут находиться как раз в тех местах, где находятся светящиеся линии в спектре испускания данного химического элемента. Эти строго установленные закономерности в линейчатых спектрах дают возможность обнаружить те или иные элементы в данном веществе.
Для определения качественного и количественного состава вещества применяется метод, основанный на получении и исследовании его спектров. Этот метод называется спектральным анализом. Это самый быстрый и простой способ определения состава различных химических соединений.
Спектр поглощения атома водорода при нормальных условиях содержит только одну серию линий, частоты которых находятся в ультрафиолетовой области.
Наиболее изученным спектром поглощения является спектр Солнца. Его сплошной спектр содержит значительное количество черных линий. Эти линии являются линиями поглощения, возникающими при прохождении света через газовую оболочку Солнца и атмосферу Земли. Они получили название фраунгоферовых линий, так как Фраунгофер впервые наблюдал спектр Солнца и установил, что закономерность их расположения не случайна и линии поглощения (темные линии) появляются всегда только на определенных местах.
Основатели спектрального анализа немецкие физики Роберт Бунзен и Густав Кирхгоф, исследуя спектры паров соединений щелочных металлов лития, натрия и калия, обнаружили новые элементы — рубидий и цезий, названные так по цвету наиболее ярких линий в их спектрах. У рубидия — красная линия, у цезия — синяя.
Спектральный анализ базируется на двух основных положениях:
1) каждый химический элемент или химическое соединение характеризуется определенным спектром;
2) интенсивность линий и полос в спектре зависит от концентрации того или иного элемента в веществе.
К достоинствам спектрального анализа исследования можно отнести:
- высокую чувствительность (обнаруживает элементы с относительной концентрацией , т. е. один атом вещества на сто миллионов других атомов);
- малое время измерения;
- малые количества исследуемого вещества (достаточно г и даже до
г) вплоть до возможности детектирования отдельных молекул;
- дистанционность измерений (можно проводить исследования, например, состава атмосферы далеких планет).
По спектрам определяют, из каких химических элементов состоит вещество и в каких количествах.
Белорусский физик академик Михаил Александрович Ельяшевич разработал основы теории колебаний многоатомных молекул и их колебательных спектров. Он внес значительный вклад в теорию спектров редкоземельных элементов и низкотемпературной плазмы.

