§ 35. Электрычны ток у электралітах
| Сайт: | Профильное обучение |
| Курс: | Фізіка. 10 клас |
| Книга: | § 35. Электрычны ток у электралітах |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 6 Июль 2025, 08:23 |
Пры вывучэнні папярэдняга параграфа вы даведаліся, што ў металах перанос зараду не суправаджаецца пераносам рэчыва, а носьбітамі свабодных зарадаў з’яўляюцца электроны. Але існуе клас праваднікоў, праходжанне электрычнага току ў якіх заўсёды суправаджаецца хімічнымі зменамі і пераносам рэчыва. Якая прырода электрычнага току ў такіх правадніках?
Прырода электрычнага току ў электралітах. З доследаў вынікае, што растворы многіх солей, кіслот і шчолачаў, а таксама расплавы солей і аксідаў металаў праводзяць электрычны ток, гэта значыць з’яўляюцца праваднікамі. Такія праваднікі назвалі электралітамі.
Электраліты — рэчывы, растворы або расплавы якіх праводзяць электрычны ток.
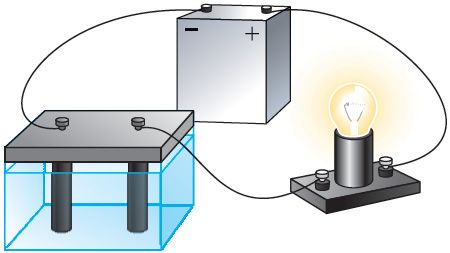
Правядзём дослед. Збяром электрычны ланцуг, які складаецца з крыніцы току, лямпы напальвання і ванны з дыстыляванай вадой, у якой знаходзяцца два вугальныя электроды. Пры замыканні ланцуга лямпа не свеціцца, значыць, дыстыляваная вада не праводзіць электрычны ток. Паўторым дослед, дадаўшы ў дыстыляваную ваду цукар. Лямпа не свеціцца і ў гэтым выпадку. Раствор цукру ў вадзе таксама не з’яўляецца правадніком. А цяпер дададзім у дыстыляваную ваду невялікую колькасць солі, напрыклад хларыду медзі(II) CuCl2. У ланцугу праходзіць электрычны ток, пра што наглядна сведчыць свячэнне лямпы (мал. 200). Такім чынам, раствор солі ў вадзе з’яўляецца правадніком электрычнага току, гэта значыць пры растварэнні хларыду медзі(II) у дыстыляванай вадзе з’явіліся свабодныя носьбіты электрычнага зараду.
Вывучаючы хімію, вы даведаліся, што пры растварэнні солей, кіслот і шчолачаў у вадзе адбываецца электралітычная дысацыяцыя, гэта значыць распад малекул электраліту на іоны. У праведзеным доследзе хларыд медзі(II) CuCl2 у водным растворы дысацыіруе на дадатна зараджаныя іоны медзі Cu2+ і адмоўна зараджаныя іоны хлору Cl–.
![]()
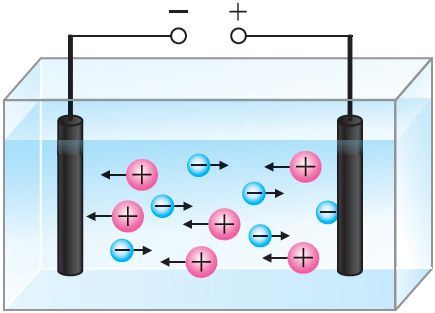
Іоны Cu2+ і Cl– у растворы пры адсутнасці электрычнага поля рухаюцца хаатычна. Пад дзеяннем знешняга электрычнага поля на хаатычны рух іонаў накладваецца іх накіраваны рух (мал. 201). Пры гэтым дадатна зараджаныя іоны Cu2+ рухаюцца да катода (электрода, які падключаны да адмоўнага полюса крыніцы току), адмоўна зараджаныя іоны Cl– — да анода (электрода, які падключаны да дадатнага полюса крыніцы току). На анодзе будзе адбывацца працэс акіслення іонаў Cl– да атамаў.
Атамы ўтвараюць малекулы хлору, якія выдзяляюцца на анодзе.
На катодзе будзе адбывацца працэс аднаўлення іонаў Cu2+ да атамаў і асаджэнне медзі.
Гэтую з’яву называюць электролізам.
Электроліз — працэс выдзялення на электродах састаўных частак раствораных рэчываў, звязаны з акісляльна-аднаўленчымі рэакцыямі, што адбываюцца пры праходжанні электрычнага току праз растворы (расплавы) электралітаў або іншых рэчываў, якія з’яўляюцца вынікам другасных рэакцый.
Такім чынам, свабодныя носьбіты электрычнага зараду ў электралітах — дадатна і адмоўна зараджаныя іоны, якія ўтвараюцца ў выніку электралітычнай дысацыяцыі, а праводнасць электралітаў з’яўляецца іоннай. Электраліты адносяць да праваднікоў другога роду.
Чаму небяспечна дакранацца неахаванымі ўчасткамі цела чалавека да неізаляваных металічных правадоў, па якіх праходзіць электрычны ток?
![]()
Закон электролізу Фарадэя. Закон электролізу быў эксперыментальна ўстаноўлены Фарадэем у
Маса m рэчыва, што выдзелілася на электродзе, прама прапарцыянальная электрычнаму зараду q, які прайшоў праз электраліт:
m = kq.
(1)
У формуле (1) каэфіцыент прапарцыянальнасці k называюць электрахімічным эквівалентам дадзенага рэчыва. Ён лікава роўны масе рэчыва, якое выдзеліліся на адным з электродаў пры праходжанні праз электраліт адзінкавага электрычнага зараду. У СІ электрахімічны эквівалент вымяраюць у кілаграмах на кулон . Значэнні электрахімічных эквівалентаў некаторых рэчываў прыведзены ў табліцы.
Электрахімічны эквівалент рэчыва
| Рэчыва | k, 10–8 |
Рэчыва | k, 10–8 |
| Алюміній | 9,32 | Нікель (двухвалентны) | 30,4 |
| Вадарод | 1,04 | Нікель (трохвалентны) | 20,3 |
| Кісларод | 8,29 | Хлор | 36,7 |
|
Медзь (аднавалентная) |
65,9 | Хром | 18,0 |
|
Медзь (двухвалентная) |
32,9 | Цынк | 33,9 |
Паколькі q = It, дзе I — сіла току, t — прамежак часу проходжання току праз электраліт, то
m = kIt.
Нікеліраванне вырабу двухвалентным нікелем ажыццяўлялася на працягу прамежку часу t = 20 мін пры сіле току I = 15 А. Вызначце масу слоя нікелю, які асеў на вырабе.
Масу m рэчыва, што выдзелілася на электродзе пры праходжанні праз электраліт электрычнага зараду q, можна вызначыць, ведаючы масу m0 аднаго іона і колькасць N іонаў, якія аселі на гэтым электродзе:
,
,
дзе М — малярная маса выдзеленага рэчыва, NA — пастаянная Авагадра.
Тады колькасць іонаў: .
З другога боку, колькасць іонаў, якія нейтралізаваліся на электродзе:
,
дзе q0 — зарад аднаго іона. Паколькі зарад іона q0 кратны элементарнаму зараду е, то q0 = en, дзе n — валентнасць іона.
Значыць, і
(2)
Параўнаўшы формулы (2) і (1), атрымаем
(3)
Паколькі NA і е — універсальныя пастаянныя, то фізічную велічыню у гонар М. Фарадэя назвалі пастаяннай Фарадэя.
Такім чынам, формулу (3) для вызначэння электрахімічнага эквівалента рэчыва можна запісаць у выглядзе:
Выкарыстоўваючы закон электролізу, можна вызначыць значэнне зараду электрона ў школьнай лабараторыі. Дапусцім, што I — сіла току, які проходзіў праз электраліт на працягу прамежку часу (можна вымераць амперметрам). Пры гэтым на электродзе выдзелілася рэчыва, маса якога m (можна вымераць, узважыўшы электрод перад і пасля праходжання току праз электраліт). Тады модуль зараду электрона вызначаюць па формуле:
Тэхнічнае прымяненне электролізу. Электроліз знайшоў розныя прымяненні ў прамысловасці. Разгледзім некаторыя з іх.
1. Нанясенне ахоўных і дэкаратыўных пакрыццяў на металічныя вырабы (гальванастэгія).
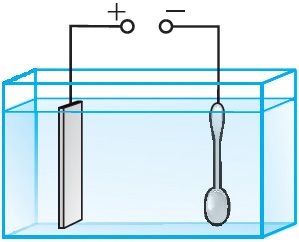
Каб засцерагчы металы ад акіслення, а таксама надаць вырабам трываласць і палепшыць знешні выгляд, іх пакрываюць тонкім слоем высакародных металаў (золата, серабра) або малаакісляльнымі металамі (хромам, нікелем). Прадмет, які падлягае гальванічнаму пакрыццю, напрыклад лыжку (мал. 202), апускаюць у якасці катода ў электралітычную ванну. Электралітам з’яўляецца раствор солі металу, якім ажыццяўляецца пакрыццё. Анодам служыць пласціна з таго ж металу. Праз электралітычную ванну на працягу пэўнага прамежку часу прапускаюць электрычны ток, і лыжка пакрываецца слоем металу патрэбнай таўшчыні. Для больш раўнамернага пакрыцця лыжкі яе неабходна змясціць паміж дзвюма ці больш аноднымі пласцінамі. Пасля пакрыцця лыжку вымаюць з ванны, сушаць і паліруюць.
2. Выраб металічных копій з рэльефных мадэлей (гальванапластыка).
Для атрымання копій прадметаў (манет, медалёў, барэльефаў і інш.) робяць злепкі з якога-небудзь пластычнага матэрыялу (напрыклад, воску). Для надання злепку электраправоднасці яго пакрываюць графітавым пылам, апускаюць у электралітычную ванну ў якасці катода і атрымліваюць на ім слой металу патрэбнай таўшчыні. Затым шляхам награвання выдаляюць воск.
Працэс гальванапластыкі быў распрацаваны ў 1836 г. рускім акадэмікам Б. С. Якобі (1801–1874).
3. Атрыманне металаў з расплаўленых руд і іх ачыстка, электрахімічная апрацоўка металаў.
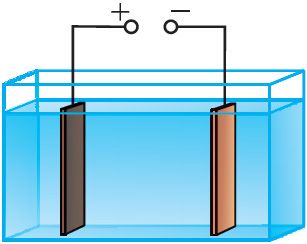
Працэс ачысткі металаў адбываецца ў электралітычнай ванне. Анодам служыць метал, які падлягае ачыстцы, катодам — тонкая пласціна з чыстага металу, а электралітам — раствор солі дадзенага металу. Напрыклад, пласціну з неачышчанай медзі змяшчаюць у якасці анода ў ванну з растворам меднага купарвасу, дзе катодам з’яўляецца ліст чыстай медзі (мал. 203). У забруджаных металах могуць утрымлівацца каштоўныя прымесі. Так, медзь часта змяшчае нікель і серабро. Пры прапусканні праз ванну электрычнага току медзь з анода пераходзіць у раствор, з раствору на катодзе выдзяляецца чыстая медзь, а прымесі выпадаюць у выглядзе асадку або пераходзяць у раствор.

![]()
1. Што называюць электралітам?
2. Якая прырода электрычнага току ў электралітах?
3. Які працэс называюць электролізам?
4. Прывядзіце прыклады прымянення электролізу.
![]()
5. Сфармулюйце закон электролізу. Які фізічны сэнс электрахімічнага эквівалента?
6. Праз электралітычную ванну, напоўненую растворам сульфату медзі(II) CuSO4, прапускаюць электрычны ток. Ці зменіцца маса медзі, якая выдзяляецца на катодзе за аднолькавыя прамежкі часу, калі павялічыць напружанне паміж электродамі? павялічыць тэмпературу раствору электраліту? павялічыць канцэнтрацыю раствору электраліту? Чаму?
Прыклад 1. Праз электралітычную ванну, якая змяшчае раствор сернай кіслаты, на працягу прамежку часу t = 60,0 мін праходзіў ток. Газападобны вадарод, які выдзеліўся на катодзе, сабраны ў пасудзіне ўмяшчальнасцю V = 350 см3. Вызначце тэмпературу вадароду, калі яго ціск p = 150 кПа, а сіла току, што праходзіў праз электралітычную ванну, I = 1,20 А.
Дадзена:
t = 60,0 мин = 3,60 · 103 с
I = 1,20 А
V = 350 см3 = 3,50 · 10–4 м3
p = 150 кПа = 1,50 · 105 Па
Рашэнне. Для знаходжання тэмпературы вадароду выкарыстаем ураўненне Клапейрона — Мендзялеева:
дзе М = 2,02 · 10–3 — малярная маса вадароду, R = 8,31
— універсальная газавая пастаяная. Значыць,
. Масу вадароду, які выдзеліўся на катодзе, вызначым, выкарыстаўшы закон электролізу: m = kIt, дзе k — электрахімічны эквівалент вадароду (k = 1,04 · 10–8
). З улікам гэтага тэмпературу вадароду разлічым па формуле
.
Адказ: Т = 284 К.
Прыклад 2. Храміраванне тонкай прамавугольнай пласцінкі даўжынёй а = .
а = 3,0 см = 3,0 · 10–2 м
b = 5,0 см = 5,0 · 10–2 м
t = 2,0 ч = 7,2 · 103 с
I = 1,5 А
ρ = 7,18 · 103
Рашэнне. Для вызначэння масы хрому, які асеў на двух баках пласцінкі, выкарыстаем закон Фарадэя: m = kIt, дзе k = 1,8 ∙ 10–7 .
З другога боку, масу хрому можна выразіць праз шчыльнасць ρ і аб'ём V: m = ρV = ρab ∙ 2h , дзе h — таўшчыня слоя хрому, які ўтварыўся на пласцінцы. З улікам гэтага: 2ρabh = kIt, адкуль таўшчыня слоя хрому:
Адказ: h = 90 мкм.
Практыкаванне 25
1. Праз водны раствор сульфату медзі(II) CuSO4, які знаходзіцца ў электралітычнай ванне, прапускаюць электрычны ток. Вызначце колькасць атамаў медзі, якія штосекундна асядаюць на катодзе ванны, калі сіла току ў ланцугу I = 4,0 А.
2. У працэсе электролізу на катодзе асядае двухвалентны нікель, утвараючы слой масай m =
3. Электроды, якія знаходзяцца ў растворы сульфату медзі(II) CuSO4, падключаны да крыніцы току з ЭРС = 12 В і ўнутраным супраціўленнем r = 0,40 Ом. Вызначце масу медзі, якая асядзе на катодзе за прамежак часу t = 10 мін, калі супраціўленне раствору паміж электродамі R = 0,60 Ом.
4. Пры электролізе слабога раствору сернай кіслаты на катодзе электралітычнай ванны выдзеліўся газападобны вадарод, тэмпература якога t = 22 ºС, ціск р = 100 кПа і аб'ём V =
5. Паветраны шар напоўнены вадародам, які захоўвае цеплавую раўнавагу з атмасферным паветрам. Невялікая адтуліна ў ніжняй частцы шара забяспечвае практычна аднолькавы ціск газу ўнутры шара і атмасфернага паветра. Маса тонкай абалонкі шара і грузу, які ён падымае, m = 2,2 ·
