§ 14. Першы закон тэрмадынамікі. Прымяненне першага закона тэрмадынамікі да ізапрацэсаў змянення стану ідэальнага газу
| Сайт: | Профильное обучение |
| Курс: | Фізіка. 10 клас |
| Книга: | § 14. Першы закон тэрмадынамікі. Прымяненне першага закона тэрмадынамікі да ізапрацэсаў змянення стану ідэальнага газу |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 6 Июль 2025, 09:05 |
У 9-м класе вы даведаліся, што поўная механічная энергія замкнутай сістэмы цел захоўваецца толькі пры адсутнасці трэння, а пры наяўнасці трэння яна памяншаецца. Куды дзяваецца механічная энергія?
Закон захавання энергіі. У сярэдзіне XIX ст. вядомы англійскі фізік Дж. Джоўль (1818–1889), правёўшы шматлікія доследы, паказаў, што выкананая пры перамешванні вады механічная работа практычна роўная павелічэнню яе ўнутранай энергіі. Доследы Джоўля, а таксама даследаванні нямецкага ўрача і прыродазнаўцы Ю. Р. Маера (1814–1878), нямецкага прафесара фізіялогіі і аднаго з самых знакамітых фізікаў другой паловы XIX ст. Г. Гельмгольца (1821–1894) дазволілі сфармуляваць закон захавання і ператварэння энергіі, распаўсюдзіўшы яго на ўсе з’явы прыроды.
Закон захавання і ператварэння энергіі: пры любых узаемадзеяннях матэрыяльных аб’ектаў энергія не знікае і не ўзнікае з нічога, яна толькі перадаецца ад адных аб’ектаў да другіх або ператвараецца з адной формы ў другую.
Закон захавання і ператварэння энергіі з’яўляецца ўсеагульным законам прыроды і звязвае разам усе фізічныя з’явы. Гэты закон выконваецца абсалютна дакладна, на ім грунтуецца ўсё сучаснае прыродазнаўства.
Калі бутэльку, запоўненую да паловы вадой пры пакаёвай тэмпературы, патрэсці на працягу некалькіх хвілін, то выявіцца, што вада нагрэлася на 1–2 °С. Што з’яўляецца прычынай павышэння тэмпературы вады?
Першы закон тэрмадынамікі. У папярэдніх параграфах мы разглядалі працэсы, у якіх унутраная энергія сістэмы змянялася або пры выкананні работы, або ў выніку цеплаабмену. Аднак часцей за ўсё пры пераходзе сістэмы з аднаго стану ў другі ўнутраная энергія змяняецца як за кошт выканання работы, так і за кошт цеплаабмену з навакольнымі целамі.
Для тэрмадынамічных сістэм закон захавання і ператварэння энергіі называюць першым законам тэрмадынамікі.
Першы закон тэрмадынамікі: прырашчэнне ўнутранай энергіі тэрма ды намічнай сістэмы пры пераходзе з аднаго стану ў другі роўнае алгебраічнай суме работы, выкананай знешнімі сіламі, і колькасці цеплаты, атрыманай (або аддадзенай) сістэмай пры ўзаемадзеянні з навакольнымі целамі.
ΔU = A′ + Q.
Паколькі работа знешніх сіл роўная рабоце, якая выконваецца тэрма ды наміч най сістэмай, узятай з супрацьлеглым знакам (A′ = –A), то першы закон тэрмадынамікі можна сфармуляваць інакш:
Колькасць цеплаты, атрыманая (або аддадзеная) тэрмадынамічнай сістэмай пры ўзаемадзеянні са знешнімі целамі пры яе пераходзе з аднаго стану ў другі, ідзе на прырашчэнне ўнутранай энергіі сістэмы і на работу, якую яна выконвае супраць знешніх сіл:
Q = ΔU + A.
Ідэальны газ атрымаў колькасць цеплаты Q = 340 Дж. Вызначце прырашчэнне ўнутранай энергіі газу, калі пры гэтым сіла ціску газу выканала работу А = 300 Дж.
![]()
Калі тэрмадынамічная сістэма ўяўляе з сябе дзеючую прыладу, якая перыядычна вяртаецца ў зыходны стан, то пры гэтым ΔU = 0 і A = Q. Механізм, які мог бы выконваць работу без змянення стану цел, што яго складаюць, і без цеплаабмену са знешнімі целамі, называюць «вечным рухавіком першага роду». Таму першы закон тэрмадынамікі можна сфармуляваць і наступным чынам: немагчыма стварыць вечны рухавік першага роду, гэта значыць такі рухавік, які пры нязменным значэнні ўласнай унутранай энергіі выконваў бы работу большую, чым энергія, якую ён атрымлівае звонку.
Прыменім першы закон тэрмадынамікі да розных ізапрацэсаў змены стану ідэальнага аднаатамнага газу.
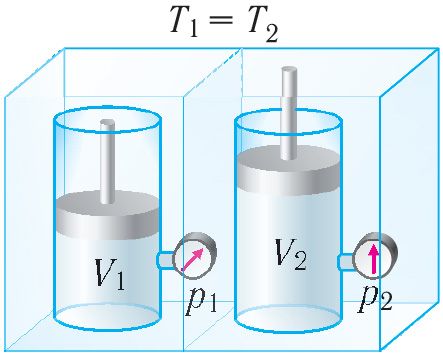
У якасці тэрмадынамічнай сістэмы разгледзім ідэальны аднаатамны газ, які знаходзіцца ў цыліндрычнай пасудзіне, закрытай поршнем.
![]()
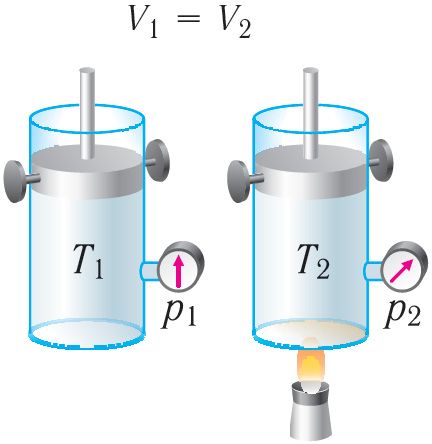
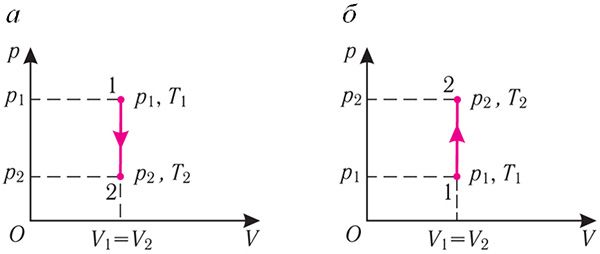
Ізахорны працэс. Няхай ідэальны аднаатамны газ знаходзіцца ў цыліндрычнай пасудзіне, якая закрыта нерухомым поршнем (V = const). Нагрэем цыліндр з газам. Аб’ём газу застаецца практычна пастаянным (цеплавое расшырэнне пасудзіны не ўлічваем) (мал. 78), значыць, работа сілы ціску газу A = 0. Тады першы закон тэрмадынамікі прыме выгляд
Гэта азначае, што ўся перададзеная газу колькасць цеплаты ідзе на павелічэнне яго ўнутранай энергіі. Пры гэтым прырашчэнне ўнутранай энергіі газу (мал. 78.1, а). А калі газ пры ізахорным працэсе аддае колькасць цеплаты, то яго ўнутраная энергія змяншаецца:
(мал. 78.1, б).
1. Вызначце прырашчэнне ўнутранай энергіі ідэальнага газу, калі пры ізахорным працэсе ад яго была адведзена колькасць цеплаты Q = –560 Дж.
![]()
2. Як змяняюцца ўнутраная энергія і ціск пэўнай масы ідэальнага газу пры ізахорным павышэнні тэмпературы?
Ізатэрмічны працэс. Няхай цыліндрычная пасудзіна з газам пад поршнем знаходзіцца ў тэрмастаце — прыладзе, у якой падтрымліваецца пастаянная тэмпература. І няхай цыліндр выраблены з рэчыва з добрай цеплаправоднасцю. У гэтым выпадку ўнутраная энергія ідэальнага аднаатамнага газу , які знаходзіцца ў цыліндры, застаецца пастаяннай, і пры павольным перамяшчэнні поршня яе змяненне ΔU = 0. Тады першы закон тэрмадынамікі прыме выгляд
Q = A.
![]()
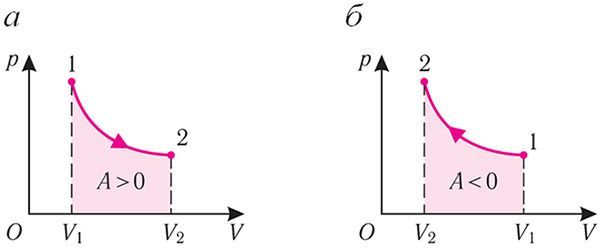
Калі з дапамогай знешняй прылады павольна перамяшчаць поршань у пасудзіне так, каб аб’ём газу павялічваўся (ΔV > 0, бо V2 > V1) (мал. 79), то работа сілы ціску газу пры расшырэнні A > 0 (мал. 79.1, а). Пры аднолькавай першапачатковай тэмпературы тэрмастата і газу цеплаперадача не адбываецца. Дадатная работа сілы ціску газу, які расшыраецца, выконваецца за кошт памяншэння яго ўнутранай энергіі, а значыць, і тэмпературы. Адразу ж узнікае цеплаперадача ад тэрмастата да газу. Пры павольным перамяшчэнні поршня ў цыліндры тэмпературы тэрмастата і газу паспяваюць выраўняцца. Адбываецца працэс, блізкі да ізатэрмічнага, пры якім газ падчас расшырэння атрымлівае некаторую колькасць цеплаты (Q > 0) ад тэрмастата.
Калі ж знешняя прылада забяспечвае павольнае памяншэнне аб’ёму газу ў пасудзіне (ΔV < 0, бо V2 < V1), то работа сілы ціску пры сцісканні газу А < 0 (мал. 79.1, б) прыводзіць да павелічэння ўнутранай энергіі, а значыць, і яго тэмпературы. У выніку ўзнікае цеплаперадача ад газу да тэрмастата. Пры сцісканні газ аддае тэрмастату некаторую колькасць цеплаты Q < 0. Ізатэрмічнае сцісканне газу адбываецца за кошт работы знешніх сіл: A' > 0.
1. Сіла ціску ідэальнага газу падчас ізатэрмічнага расшырэння выканала работу А = 3640 Дж. Якую колькасць цеплаты атрымаў газ?
![]()
2. Ці можа адбывацца ізатэрмічнае сцісканне (расшырэнне) пэўнай масы ідэальнага газу без цеплаабмену?
![]()
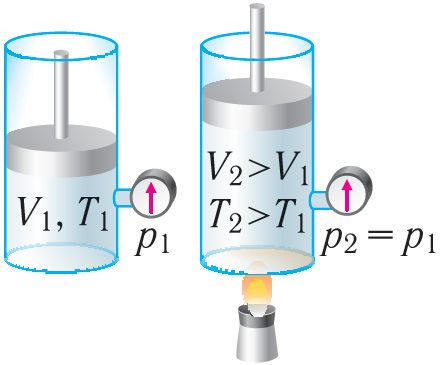
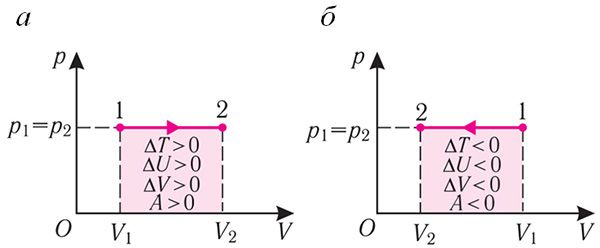
Ізабарны працэс. Няхай газ знаходзіцца ў цыліндрычнай пасудзіне, закрытай поршнем, які можа свабодна або пад пастаяннай нагрузкай перамяшчацца (мал. 80). Нагрэем газ, перадаўшы яму некаторую колькасць цеплаты (Q > 0). Паводле першага закона тэрмадынамікі перададзеная газу колькасць цеплаты часткова расходуецца на павелічэнне ўнутранай энергіі (ΔU > 0) сістэмы і часткова ідзе на выкананне работы сілай ціску газу пры яго расшырэнні (А > 0, мал. 80.1, а): Q = ΔU + A.
Пры ізабарным працэсе работа расшырэння (сціскання) газу A = pΔV ≠ 0, і першы закон тэрмадынамікі прымае выгляд
Q = ΔU+ pΔV.
Пры ізабарным сцісканні газу знешнія сілы выконваюць работу A' > 0. Каб ціск газу пры гэтым заставаўся пастаянным, газ неабходна ахалоджваць, гэта значыць ён павінен аддаваць у навакольнае асяроддзе некаторую колькасць цеплаты (Q < 0). Паніжэнне тэмпературы газу пры ізабарным сцісканні прыводзіць да памяншэння яго ўнутранай энергіі (ΔU < 0). Работа сілы ціску газу пры сцісканні А < 0 (мал. 80.1, б).
Сіла ціску ідэальнага газу падчас ізабарнага расшырэння выканала работу А = 320 Дж. Пры гэтым газ атрымаў колькасць цеплаты Q = 680 Дж. Вызначце прырашчэнне ўнутранай энергіі ідэальнага газу.
![]()
Удзельная цеплаёмістасць рэчыва залежыць не толькі ад яго ўласцівасцей, але і ад характару ажыццяўлення працэсу цеплаабмену. Сапраўды, з формулы Q = cmΔT вынікае, што ўдзельная цеплаёмістасць .
Тады згодна з першым законам тэрмадынамікі пры ізахорным працэсе ўдзельная цеплаёмістасць ідэальнага газу , а пры ізабарным —
. Такім чынам, для аднолькавага павелічэння тэмпературы пры ізабарным награванні адзінцы масы газу неабходна перадаць большую колькасць цеплаты, чым пры ізахорным награванні, гэта значыць cp > cV. Гэта тлумачыцца тым, што пры пастаянным ціску частка перададзенай энергіі расходуецца на выкананне сілай ціску газу работы пры расшырэнні.
Расшырэнне вадкіх і цвёрдых цел пры награванні пры пастаянным ціску значна меншае, чым газаў, таму для іх АΔU і іх удзельныя цеплаёмістасці мала залежаць ад характару працэсу (ср ≈ сV).
Адыябатны працэс. Адыябатным называюць працэс, падчас якога тэрмадынамічная сістэма не атрымлівае і не аддае энергію шляхам цеплаабмену. Такім чынам, пры адыябатным працэсе
Q = 0.
Прымяніўшы да гэтага працэсу першы закон тэрмадынамікі, атрымаем:
ΔU = −A , або A = −ΔU.
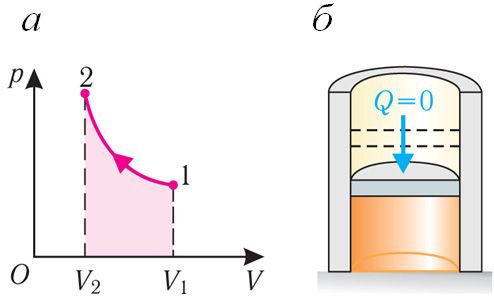
Пры адыябатным працэсе змяненне ўнутранай энергіі сістэмы адбываецца толькі за кошт выканання работы. Калі знешнія сілы выконваюць работу па сцісканні газу (ΔV < 0, А < 0) (мал. 80.2, а, б), то ўнутраная энергія газу павялічваецца (ΔU > 0), газ награваецца.
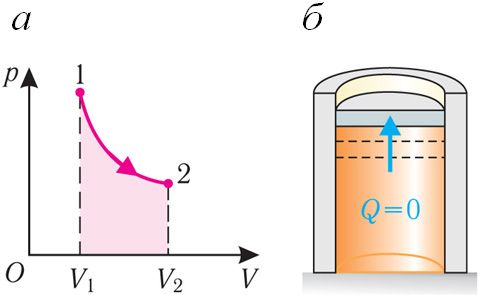
Калі сіла ціску газу выконвае работу па расшырэнні (ΔV > 0, А > 0) (мал. 80.3, а, б), то ўнутраная энергія газу памяншаецца (ΔU < 0), газ ахалоджваецца.
1. Пры адыябатным расшырэнні сілай ціску ідэальнага газу выканана работа А = 265 Дж. Як змянілася пры гэтым тэмпература газу? Вызначце прырашчэнне ўнутранай энергіі газу.
2. У цыліндры з рухомым поршнем знаходзіцца ідэальны газ, ціск якога р1 і аб’ём V1. У якім выпадку сіла ціску газу выканае большую работу: пры ізатэрмічным або пры адыябатным яго расшырэнні да аб'ёму V2?
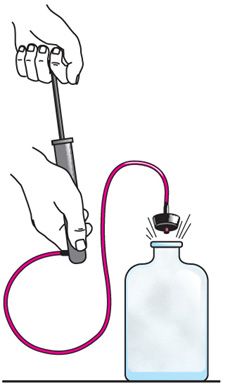
На практыцы адыябатны працэс ажыццяўляюць галоўным чынам не за кошт цеплаізаляцыі (нельга акружыць сістэму абалонкай, якая абсалютна не дапускае цеплаабмену), а за кошт хуткасці праходжання працэсу. Калі працэс ідзе вельмі хутка, то цеплаабмен практычна не адбываецца. Можна правесці вельмі наглядны дослед, які ілюструе памяншэнне тэмпературы газу пры яго адыябатным расшырэнні. Выкарыстоўваючы помпу, будзем праз адтуліну ў корку напампоўваць у шкляную пасудзіну паветра (мал. 80.4). Праз некаторы прамежак часу напампоўвання сіла ціску сціснутага паветра выканае работу па пераадоленні сілы трэння, якой пасудзіна дзейнічае на корак, і сілы атмасфернага ціску. Цеплаабмен паміж пасудзінай і навакольнымі целамі не паспявае праявіцца за той малы прамежак часу, на працягу якога корак вылятае з пасудзіны і частка газу выходзіць з яго. Памяншэнне ўнутранай энергіі паветра ў пасудзіне абумоўлена не толькі змяншэннем масы, але і паніжэннем яго тэмпературы, што прыводзіць да кандэнсацыі вадзяной пары, гэта значыць да ўтварэння туману.
У якасці прыкладу адыябатнага працэсу можна прывесці ахаладжэнне паветра ў атмасферы. Нагрэтае каля паверхні Зямлі паветра падчас хуткага пад’ёму ў верхнія слаі атмасферы расшыраецца амаль адыябатна і пры гэтым істотна ахалоджваецца. Вадзяная пара ў ім кандэнсуецца ў маленькія кроплі вады і крышталікі лёду, утвараючы воблакі.
Блізкі да адыябатнага працэс выкарыстоўваюць у рухавіках унутранага згарання.
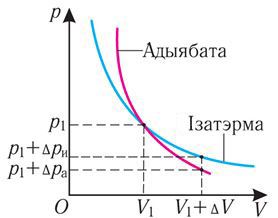
Графік адыябатнага працэсу ў каардынатах (p, V) падобны на графік ізатэрмічнага працэсу (мал. 80.5). Аднак аднаму і таму змяненню аб’ёму ΔV пры адыябатным працэсе адпавядае большае змяненне ціску, чым пры ізатэрмічным: . Гэта тлумачыцца тым, што ў выпадку адыябатнага расшырэння ціск p = nkT памяншаецца не толькі за кошт павелічэння аб’ёму газу (і памяншэння канцэнтрацыі часціц), але і за кошт змяншэння тэмпературы. Пры ізатэрмічным расшырэнні ціск газу памяншаецца толькі за кошт памяншэння канцэнтрацыі часціц.

![]()
1. Прывядзіце дзве фармулёўкі першага закона тэрмадынамікі.
2. Чаму роўная змена ўнутранай энергіі пры ізахорным працэсе?
3. На што расходуецца колькасць цеплаты, якую перадаюць сістэме, пры ізатэрмічным працэсе?
4. На што расходуецца колькасць цеплаты, якую перадаюць сістэме, пры ізабарным працэсе?
5. Пры хуткім сцісканні газу адбылося павышэнне яго тэмпературы. Ці азначае гэта, што газу перадалі пэўную колькасць цеплаты? Ці можна сцвярджаць, што ўнутраная энергія газу павялічылася?
![]()
6. Чаму немагчыма стварыць «вечны рухавік першага роду»?
7. Ці можна перадаць газу некаторую колькасць энергіі шляхам цеплаабмену, не выклікаючы пры гэтым павышэння яго тэмпературы? Прывядзіце прыклады.
8. Які працэс змянення стану газу называюць адыябатным? Як гэты працэс можна ажыццявіць?
9. У § 12 мы сцвярджалі, што работа, выкананая пры пераходзе сістэмы з аднаго стану ў другі, з'яўляецца функцыяй працэсу, гэта значыць залежыць не толькі ад пачатковага і канчатковага станаў, але і ад віду працэсу. Выкарыстоўваючы першы закон тэрмадынамікі, дакажыце, што колькасць цеплаты, якую атрымлівае або аддае сістэма пры яе пераходзе з аднаго стану ў другі, таксама з'яўляецца функцыяй працэсу.
10. Запоўніце табліцу ў сшытку.
| Працэс | Работа сілы ціску газу | Колькасць цеплаты | Змена ўнутранай энергіі | Выснова |
| Ізахорны (V = const и ΔV = 0) | ||||
| Ізатэрмічны (Т = const и ΔТ = 0) | ||||
| Ізабарны (р = const) | ||||
| Адыябатны (ΔU = −A) |
Прыклад 1. Ідэальны аднаатамны газ, ціск якога p = 2,0 · 105 Па, ізабарна расшыраецца так, што яго аб’ём узрастае на ΔV = 0,40 м3. Вызначце прырашчэнне ўнутранай энергіі газу і колькасць цеплаты, атрыманую газам у гэтым працэсе.
p = 2,0 · 105 Па
ΔV = 0,40 м3
р = const
Q — ?
Рашэнне. рырашчэнне ўнутранай энергіі ідэальнага аднаатамнага газу . Пры ізабарным расшы рэнні ідэальнага газу змяненне яго тэмпературы
звязана са змяненнем аб’ёму
газу суадносінамі
.
Тады . Паводле першага закона тэрмадынамікі для ізабарнага працэсу
.
Значыць, .
Адказ: ΔU = 0,12 МДж, Q = 0,20 МДж.
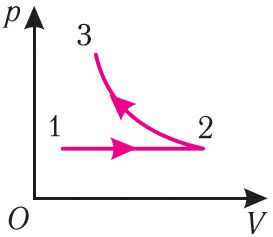
Прыклад 2. На малюнку 81 прыведзены графік працэсу змянення стану пэўнай масы ідэальнага газу (участак 2 3 — ізатэрма). На якім участку графіка работа сілы ціску газу: а) дадатная; б) адмоўная? На якім участку графіка газ: а) атрымліваў колькасць цеплаты; б) аддаваў? Як змянялася ўнутраная энергія газу?
Рашэнне. Участак 1 2. ППаколькі пры пастаянным ціску (р = const, р1 = р2) павялічваецца аб’ём газу (ΔV12 > 0), то расце і яго тэмпература (ΔТ12 > 0). Значыць, работа сілы ціску газу А12 > 0 і прырашчэнне яго ўнутранай энергіі ΔU12 > 0. З першага закона тэрмадынамікі, запісанага ў выглядзе Q12 = ΔU12 + А12, вынікае, што Q12 > 0.
Участак 2 3. Паколькі тэмпература газу не змяняецца (Т = const, Т2 = Т3, ΔТ23 = 0), то прырашчэнне яго ўнутранай энергіі ΔU23 = 0. Аб’ём газу памяншаецца (ізатэрмічнае сцісканне), і работа сілы ціску газу А23 < 0. З першага закона тэрмадынамікі, запісанага ў выглядзе Q23 = ΔU23 + А23, вынікае, што Q23 < 0.
Адказ:
| Участак графіка | Работа сілы ціску газу | Колькасць цеплаты | Прырашчэнне ўнутранай энергіі газу |
| 1 |
А12 > 0 | Q12 > 0 (газ атрымліваў колькасць цеплаты) | ΔU12 > 0 |
| 2 |
А23 < 0 | Q23 < 0 (газ аддаваў колькасць цеплаты) | ΔU23 = 0 |
![]()
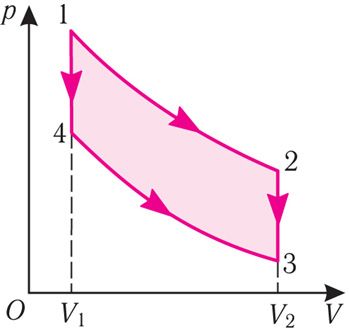
Прыклад 3. Ідэальны газ, маса якога пастаянная, пераводзяць са стану 1 у стан 3 двума рознымі спосабамі: 1 → 2 → 3 і 1 → 4 → 3 (мал. 81.1), дзе 1 → 2 і 4 → 3 — ізатэрмы, а 2 → 3 і 1 → 4 — ізахоры. Ці аднолькавыя пры гэтых пераходах: а) прырашчэнні ўнутранай энергіі газу; б) работы, якія выконваюцца сілай ціску газу; в) колькасці цеплаты, перададзеныя газу?
Рашэнне. а) Паколькі пачатковы і канчатковы станы для абодвух пераходаў аднолькавыя, то аднолькавыя і прырашчэнні ўнутранай энергіі:
ΔU123 = ΔU143 = U3 – U1.
б) Разгледзеўшы малюнак, можна зрабіць выснову, што плошча фігуры, абмежаванай воссю OV, ізатэрмай і ізахорамі, якія праходзяць праз пункты 3 і 4, меншая за плошчу фігуры, абмежаванай воссю OV, ізатэрмай і ізахорамі, якія праходзяць праз пункты 1 і 2. Значыць, у працэсе пераходу 1 → 2 → 3 сіла ціску газу выконвае большую работу, чым у працэсе пераходу 1 → 4 → 3:
А123 > А143.
в) З першага закона тэрмадынамікі вынікае:
Q123 = ΔU13 + А123, Q143 = ΔU13 + А143.
Паколькі прырашчэнне ўнутранай энергіі ў абодвух выпадках адно і тое, а выкананая сілай ціску газу работа большая пры пераходзе 1 → 2 → 3, то колькасць цеплаты, перададзеная газу, пры пераходзе 1 → 2 → 3 таксама будзе большая: Q123 > Q143.
Адказ: а) ΔU123 = ΔU143; б) А123 > А143; в) Q123 > Q143.
Практыкаванне 10
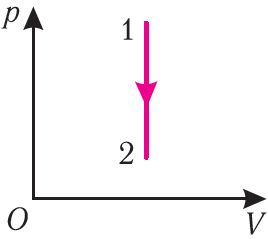
1. Вызначце колькасць цеплаты, перададзеную кіслароду, калі пры ізатэрмічным расшырэнні работа, выкананая сілай ціску газу, А = 6,4 кДж.
2. З ідэальным газам пэўнай масы ажыццёўлены працэс, графік якога прыведзены на малюнку 82. Чаму роўная работа сілы ціску газу? Атрымліваў ці аддаваў газ колькасць цеплаты ў гэтым працэсе? Як змянілася ўнутраная энергія газу?
Запоўніце табліцу ў сшытку (гл. прыклад 2).
| Работа сілы ціску газу | Колькасць цеплаты | Прырашчэнне ўнутранай энергіі газу |
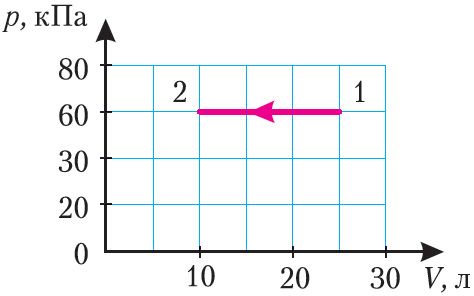
3. З ідэальным газам пэўнай масы ажыццявілі працэс, графік якога прыведзены на малюнку 83. Вызначце прырашчэнне ўнутранай энергіі газу, калі ён аддаў колькасць цеплаты Q12 = –2,25 кДж.
4. У герметычна закрытым балоне знаходзіцца азот масай m = 4,00 кг. Вызначце колькасць цеплаты, якую перадалі азоту пры павышэнні яго тэмпературы на ΔT = 120 К, калі ўдзельная цеплаёмістасць азоту пры пастаянным аб’ёме .
5. Пры ізабарным расшырэнні сілай ціску ідэальнага аднаатамнага газу выканана работа А = 50,0 кДж. Вызначце прырашчэнне ўнутранай энергіі газу і перададзеную яму колькасць цеплаты.
![]()
6. Ідэальны газ, колькасць рэчыва якога пастаянная, зведвае адыябатнае сцісканне. Як змяняюцца ў гэтым працэсе ціск і тэмпература газу? Выберыце правільнае сцвярджэнне.
1) Ціск і тэмпература газу памяншаюцца.
2) Ціск павялічваецца, а тэмпература газу памяншаецца.
3) Ціск памяншаецца, а тэмпература газу павялічваецца.
4) Ціск і тэмпература газу павялічваюцца.
5) Ціск павялічваецца, а тэмпература газу не змяняецца.
7. Гелій, колькасць рэчыва якога ν = 2 моль, які знаходзіўся пры тэмпературы T = 300 К, спачатку ізабарна нагрэлі, а затым ізахорна перавялі ў стан з тэмпературай, роўнай пачатковай. Вызначце, у колькі разоў павялічыўся аб’ём гелію, калі алгебраічная сума колькасцей атрыманай і аддадзенай цеплаты Q = 5 кДж.